Les ressources naturelles en eau au Maroc sont parmi les plus faibles au monde. En effet, le potentiel des ressources en eau naturelles est évalué à 22 milliards m³ par an, soit l'équivalent de 750 m³/habitant/an, communément admis comme seuil critique indiquant l'apparition de pénuries et de crise latente d'eau. Plus de la moitié de ces ressources sont concentrées dans les bassins du nord et le Sebou couvrant près de 7 % du territoire national. À cette limitation des ressources en eau s'ajoute la dégradation de la qualité de l’eau suite à l’augmentation de la pollution.
Dans ce contexte et pour résoudre ce problème crucial et minimiser l'utilisation abondante de l'eau potable, plusieurs recherches ont été réalisées dans le but de réutiliser les effluents liquides, particulièrement les lixiviats des déchets ménagers et industriels, pour l'irrigation des sols et autres. Devant cette situation, nous avons développé un système simple d’infiltration-percolation très efficace, en utilisant des adsorbants naturels très abondants comme le sable marin, les cendres volantes et le sol argileux. Les résultats des analyses obtenus après purification sont très positifs et présentent des abattements de la matière organique très significatifs. Les paramètres analysés dans ce travail sont le pH, la conductivité, la matière en suspension (MES), la matière organique (DCO), les chlorures, les orthophosphates (PO₄³⁻) et l’ammonium (NH₄⁺).
Les ressources naturelles en eau au Maroc sont parmi les plus faibles au monde. En effet, le potentiel des ressources en eau naturelles est évalué à 22 milliards m³ par an, soit l'équivalent de 750 m³/habitant/an, communément admis comme seuil critique indiquant l'apparition de pénuries et de crise latente d'eau. Plus de la moitié de ces ressources sont concentrées dans les bassins du nord et le Sebou couvrant près de 7 % du territoire national. À cette limitation des ressources en eau s'ajoute la dégradation de la qualité de l'eau suite à l'augmentation de la pollution. Dans ce contexte et pour accompagner le développement du pays, le Maroc s'est engagé depuis longtemps dans la voie de la maîtrise de ces ressources en eau à travers la réalisation de 135 grands barrages totalisant une capacité de près de 17,5 milliards de m³ et de plusieurs milliers de forages et de puits captant les eaux souterraines. Toutefois, le secteur
ANALYSE PHYSICO-CHIMIQUE DES LIXIVIATS DES DÉCHETS MÉNAGERS ET INDUSTRIELS
L’eau reste confrontée à des défis liés principalement à la raréfaction des ressources en eau sous l’effet des changements climatiques, à la surexploitation des ressources en eau souterraine, à la faiblesse de la valorisation des ressources en eau mobilisées notamment dans le domaine agricole et à la détérioration de la qualité des ressources en eau à cause du retard dans l’assainissement, l’épuration des effluents liquides et la réutilisation des eaux usées épurées. Ce problème a obligé les chercheurs à bien réfléchir à des solutions adéquates, afin d’établir une bonne exploitation de cette ressource vitale, et en particulier à la réutilisation des eaux usées pour l’exploitation agricole.
Les méthodes de purification des effluents liquides sont multiples, mais celle d’infiltration-percolation reste la plus utilisée et la plus efficace, grâce à sa simplicité, son coût d’exploitation et particulièrement son rendement épuratoire. Dans cet objectif, nous avons utilisé cette méthode d’infiltration-percolation en utilisant une matrice purifiante formée de sable marin de taille granulométrique bien étudiée, de cendres volantes et de sol argileux. Les principaux paramètres physico-chimiques analysés dans notre étude sont le pH, la conductivité, la matière en suspension (MES), la matière organique (DCO), les chlorures, les orthophosphates PO₄³⁻ et l’ammonium (NH₄⁺) [1-15].
La filtration des effluents liquides par infiltration-percolation à travers des adsorbants naturels est une technique efficace pour éliminer les polluants et améliorer la qualité de l’eau. Le matériau poreux permet à l’eau de passer à travers tout en retenant les particules et les polluants. Les adsorbants naturels utilisés dans notre recherche sont des produits naturels tels que le sable marin, les cendres volantes et le sol argileux [16-25].
DESCRIPTIONS DES ADSORBANTS
Sable.
Le sable utilisé, de taille granulométrique bien choisie, provient de la plage de la ville d’El Jadida. Ce dernier a été nettoyé, lavé et séché dans une étuve à 40 °C, puis analysé par diffraction X pour déterminer précisément la teneur en calcite et en silice, et finalement par spectroscopie ICP (Inductively Coupled Plasma) pour s’assurer de l’absence de traces de métaux lourds.
Le sable peut retenir les particules fines et les polluants présents dans les eaux usées, tels que les sédiments, les bactéries et les virus. De plus, il peut adsorber les polluants présents dans les eaux usées, tels que les métaux lourds, les pesticides et les produits chimiques, et finalement échanger des ions avec ces polluants, ce qui permet de les éliminer.
À l’issue d’une analyse granulométrique réalisée sur une colonne constituée de douze tamis empilés verticalement dans un ordre de maille décroissant de 2000 à 50 µm (méthode normalisée NF P 18-560), un échantillon de sable a été sélectionné parmi les échantillons prélevés. L’échantillon sélectionné se caractérise par une taille granulométrique de 100 µm (voir Figures 1 et 2). Des études réalisées dans notre laboratoire ont montré que plus la taille des échantillons de sable est fine, plus la vitesse d’infiltration diminue, ce qui améliore le temps de contact et le rendement épuratoire.
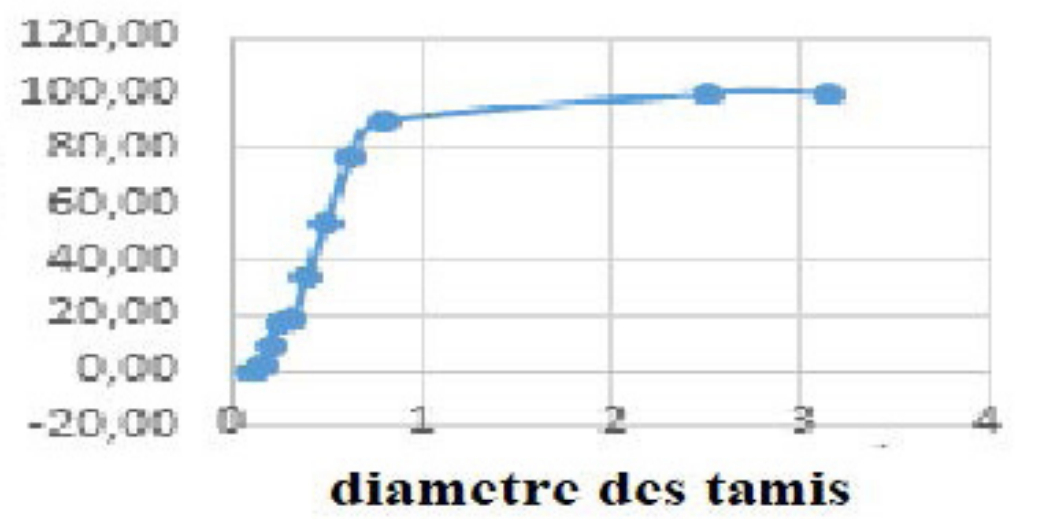
…est faible et plus les échantillons concernés manifestent une bonne rétention de l'eau et des matières dissoutes [26-35].
La composition chimique du sable utilisé est déterminée par fluorescence X. Rappelons que cette technique consiste à bombarder la cible à analyser par un flux de photons d'énergie suffisante pour ioniser des niveaux électroniques profonds des éléments qui la composent. La désexcitation se traduit par l'émission de rayonnements caractéristiques des éléments ionisés.
L'analyse qualitative est effectuée après la séparation des raies à l'aide d'un cristal analyseur. L'analyse quantitative est menée à partir du nombre de photons émis, obtenu expérimentalement à l'aide d'un compteur proportionnel. Les intensités corrigées des effets inter-éléments sont corrélées linéairement aux concentrations de matériaux de référence. Le résultat de l'analyse est présenté dans le tableau 1. Les éléments majoritaires qui composent notre sable sont la silice et la calcite [36-39].

Pour déterminer les concentrations des éléments à l'état de trace, notamment les métaux lourds, une prise d’essai de sable a été soumise à l'attaque acide par une solution composée de HNO₃ et de HCl. Après dissolution complète, la solution est filtrée puis analysée par spectrométrie d’émission atomique ICP. Il s'agit d'une technique analytique très sensible qui permet de mesurer les concentrations de tous les éléments du tableau périodique. La méthode consiste à ioniser l’échantillon en l'injectant dans un plasma d'argon ou d'hélium. En effet, les atomes de la matière à analyser sont transformés en ions par une flamme extrêmement chaude dont la température peut atteindre 8000 K. Un tel processus engendre l'ionisation des atomes. Après retour à l'état fondamental, ces atomes émettent des photons dont l'énergie (ou longueur d’onde) est caractéristique de chaque élément. Les rayonnements émis sont analysés en longueur d’onde et en intensité, ce qui permet de faire des analyses qualitative et quantitative. En comparant l’intensité émise à celle produite par le même élément contenu dans un étalon analysé dans les mêmes conditions, il est possible de déterminer la concentration de l’élément dans l’échantillon considéré. Les résultats de l'analyse par ICP de l’échantillon de sable sont reportés dans le tableau 2.
Cendres volantes.
Les cendres volantes sont des particules non combustibles entraînées par les fumées lors de la combustion du charbon pulvérisé utilisé dans les centrales thermiques. Leur composition minéralogique est variée et dépend des différents types de matières incombustibles présentes dans le charbon. D'une façon générale, elles sont constituées d’aluminosilicates vitrifiés de calcium, fer, magnésium, potassium et sodium, associées à des phases de quartz, de silicate d'aluminium et de magnétite. Les cendres volantes sont des matériaux poreux qui peuvent éliminer les éléments polluants des eaux usées grâce à leurs propriétés physico-chimiques. Les cendres volantes ont une surface spécifique élevée, ce qui leur permet d’adsorber les polluants présents dans les eaux usées, tels que les métaux lourds, les pesticides et les produits chimiques. Elles peuvent précipiter les polluants présents dans les eaux usées, tels que les phosphates et les nitrates et peuvent échanger des ions avec les polluants présents dans les eaux usées, ce qui permet de les éliminer [40-55].
Les cendres utilisées dans les expériences de filtration percolation sont produites dans la centrale thermique de Jorf Lasfar. Les cendres volantes étudiées se présentent sous forme de grains très fins. Leur granularité est relativement serrée, presque la totalité du matériau étant comprise entre 5 et 20 microns. Le refus au tamis de 80 microns est généralement entre 10 et 20 % en poids et le refus au tamis de 50 microns est entre 15 et 40 %. À noter qu'au sein d'une même production, la granularité des cendres volantes paraît assez variable.
La composition chimique des cendres volantes (CV) a été déterminée par ICP. Les résultats obtenus (tableau 3) montrent que les éléments majoritaires de ces cendres sont SiO₂ et Al₂O₃. Le pourcentage global de ces deux éléments, augmenté de celui de Fe₂O₃, est de 94,4 %. Une telle caractéristique…
ANALYSE PHYSICO-CHIMIQUE DES LIXIVIATS DES DÉCHETS MÉNAGERS ET INDUSTRIELS
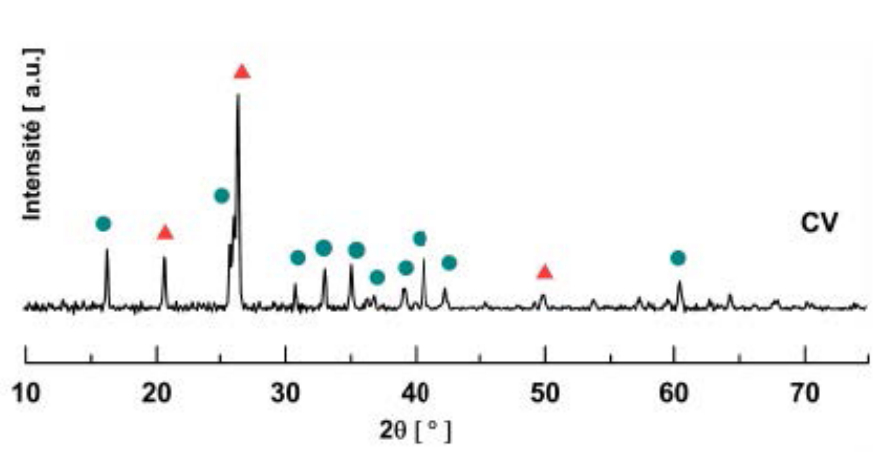
La composition minéralogique des cendres volantes est déterminée par diffraction des rayons X (voir Figure 4). Le spectre obtenu révèle l’existence de plusieurs raies qui sont identifiées au quartz et à la mullite. Un halo diffus est également observé sur le spectre et traduit la présence d’une phase amorphe. En tenant compte de l’histoire d’élaboration de ces cendres, il est possible d’expliquer cette minéralogie, en considérant la composition du charbon initial.
La silice et les minéraux phylliteux du groupe des argiles (schistes) présents dans le charbon initial subissent, au cours de la combustion, des changements de structure et donnent naissance à une faible partie cristallisée sous forme de mullite et de quartz et d’une partie amorphe [56-60].
Sol. Le sol argileux constitue un matériau naturel qui présente des propriétés intéressantes pour la filtration des eaux usées. Ces derniers ont des surfaces spécifiques élevées, permettant ainsi d’adsorber les polluants présents dans les effluents liquides tels que les sédiments, les bactéries et les virus, les métaux lourds, les pesticides et les produits chimiques. Leurs chargements électriques négatifs leur permettent de retenir les ions positifs présents dans les eaux usées. Leur porosité élevée permet de laisser passer les particules fines et de retenir les particules plus grosses [61-65]. Finalement, le sol argileux est stable chimiquement, ce qui le rend résistant à la corrosion et à la dégradation et surtout efficace pour éliminer les polluants organiques et inorganiques. L’analyse chimique de ce matériau a été réalisée par fluorescence X selon trois types de programmation de l’appareil : calcaire, schiste et marne. Les valeurs moyennes, exprimées en pourcentage d’oxyde des divers éléments contenus dans le sol argileux, sont présentées dans le tableau 4.
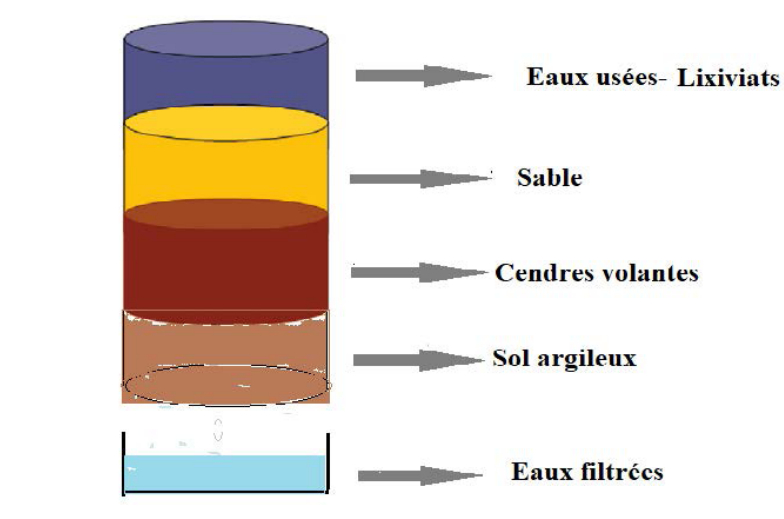
Le montage expérimental de la filtration-percolation utilisé est présenté par la figure 5. Il s’agit d’un cylindre de longueur L et de section S. La matrice purifiante utilisée est composée de trois étages de même hauteur formés par le sable marin de taille granulométrique 100 µm, les cendres volantes et le mélange sol agricole et tourbe.
RÉSULTATS ET DISCUSSION
Les eaux usées, qui sont les lixiviats des déchets ménagers et industriels, ont été prélevées directement au niveau des sites d’entassement de ces derniers. Ces échantillons ont été placés dans des bouteilles hermétiques à l’abri de la lumière.
Les paramètres physico-chimiques analysés ainsi que les résultats obtenus avant traitement des eaux usées étudiées sont rassemblés dans le tableau 5. Le tableau 6 résume les valeurs retrouvées pour ces mêmes paramètres physico-chimiques après purification.
Tableau 4 : Composition chimique du sol argileux exprimée en pourcentage massique (%).
| Calcaire | SiO₂ 60,11 | Al₂O₃ 4,43 | Fe₂O₃ 3,54 | CaO 22,9 | MgO 1,60 | K₂O 0,38 | SO₃ 0,01 |
|---|---|---|---|---|---|---|---|
| Schiste | SiO₂ 66,31 | Al₂O₃ 1,00 | Fe₂O₃ 3,60 | CaO 17,40 | MgO 1,71 | K₂O 0,72 | SO₃ 0,11 |
| Marne | SiO₂ 62,05 | Al₂O₃ 3,84 | Fe₂O₃ 4,30 | CaO 15,03 | MgO 1,63 | K₂O 0,57 | SO₃ 0,00 |
par notre matrice filtrante constituée de sable marin de taille granulométrique 100 µm, de cendres volantes et de sol argileux.
Pour mieux visualiser les abattements obtenus après filtration par nos adsorbants, nous avons présenté ces résultats sous forme d’histogrammes.
Évolution du pH.
Les eaux usées étudiées ont un pH acide, comme on peut le constater sur la figure 6. La filtration de ces rejets par nos matrices a conduit à la neutralisation de ces eaux.
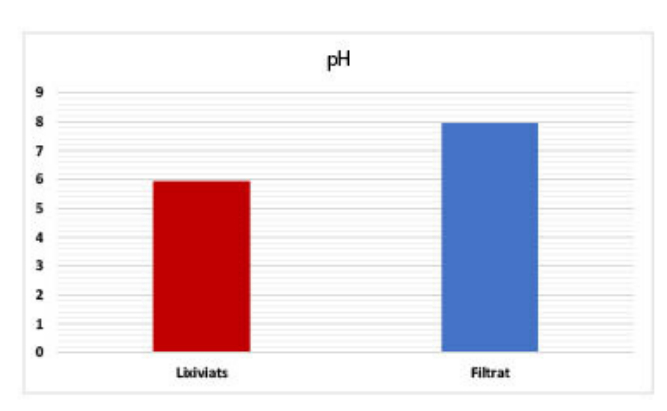
La détermination du pH constitue une mesure très importante car la valeur du pH conditionne un grand nombre de réactions biologiques et chimiques dans les eaux naturelles ; toute modification du pH peut donc causer des déséquilibres physico-chimiques des milieux récepteurs. Les eaux usées étudiées ont un caractère acide. La filtration de ces rejets liquides à travers notre matrice formée de sable marin, de cendres volantes et de sol a permis leur neutralisation. Cette neutralisation peut être expliquée par le caractère basique des supports filtrants [66-75].
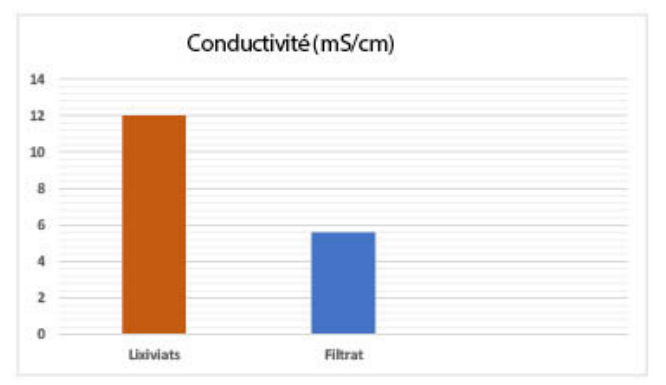
Les effluents liquides étudiés présentent une très forte conductivité électrique qui traduit le degré de minéralisation globale, avec une valeur dépassant les 12 mS·cm⁻¹ comme indiqué dans la figure 7.
Cette conductivité élevée est due aux sels dissous dans ces rejets. Le passage de ces eaux usées à travers les différents supports filtrants a permis la rétention des sels dissous dans l’eau par adsorption ou diffusion ionique dans les feuillets argileux constituant nos supports filtrants, ce qui traduit la réduction de la conductivité [76-80].
Les matières en suspension regroupent l’ensemble des particules fines, insolubles, colloïdales, de nature organique ou minérale, biodégradables ou non. Ces particules augmentent la turbidité des eaux, empêchent la pénétration de la lumière et réduisent le phénomène de photosynthèse, causant ainsi un appauvrissement en oxygène dissous au niveau des milieux récepteurs.
Les eaux usées étudiées sont chargées en matières en suspension, avec des valeurs dépassant les 6000 mg par litre. Le passage
Tableau 5 : Les paramètres physico-chimiques des eaux usées étudiées avant traitement.
| pH : 5,96 |
| Conductivité (mS/cm) : 12,01 |
| MES (mg/l) : 6001 |
| DCO (mg/l) : 689 |
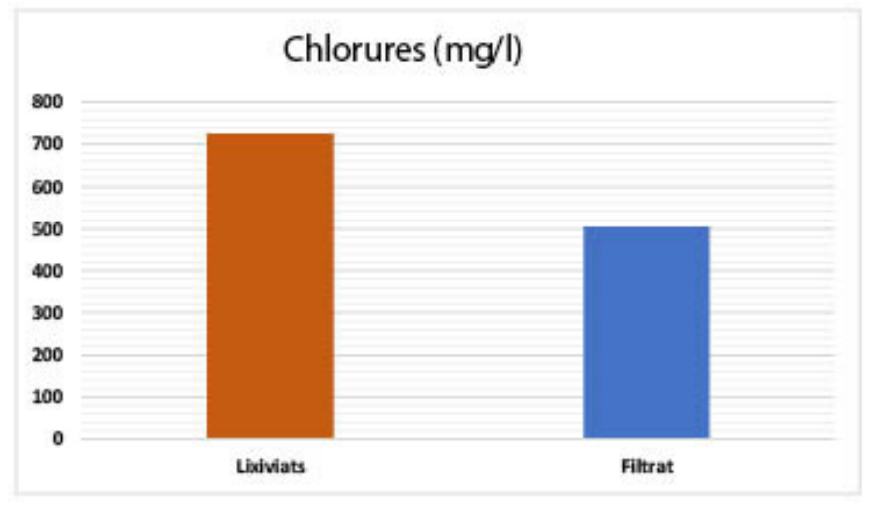
| Chlorures (mg/l) : 726,12 |
| Phosphore (mg/l) : 75,28 |
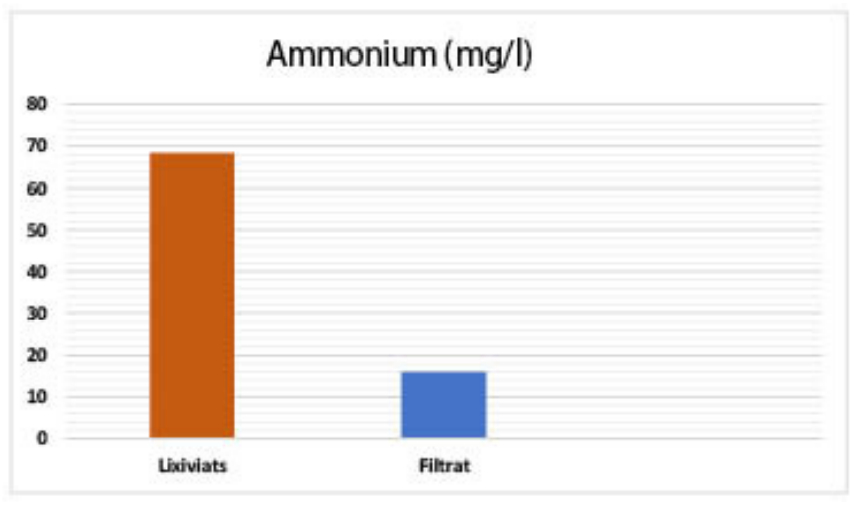
| Ammonium (mg/l) : 68,52 |
Tableau 6 : Les principaux paramètres physico-chimiques des eaux usées après filtration.
| Eaux usées (Lixiviat) – Filtrat |
| pH : 5,96 – 7,97 |
| Conductivité (mS/cm) : 12,01 – 5,6 |
| MES (mg/l) : 6001 – 105 |
| DCO (mg/l) : 689 – 280 |
| Chlorures (mg/l) : 726,12 – 504,32 |
| Phosphore (mg/l) : 75,28 – 12,14 |
| Ammonium (mg/l) : 68,52 – 16,03 |
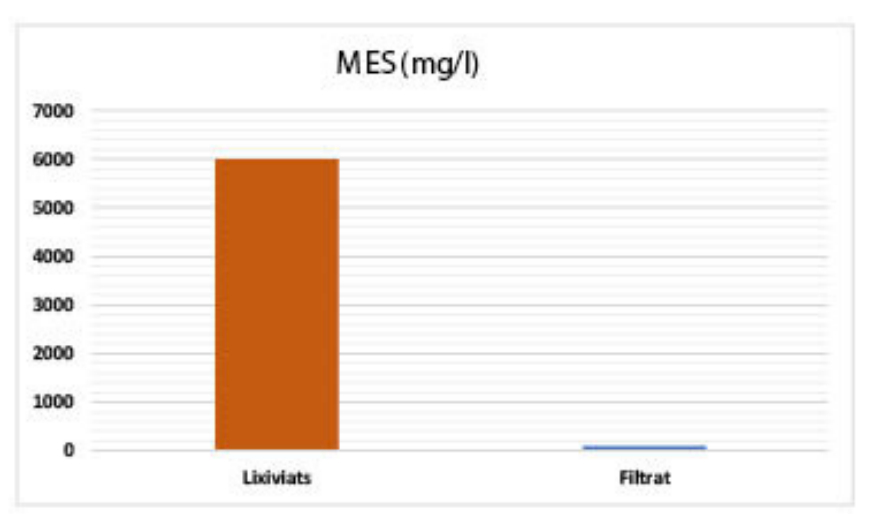
Le passage de ces effluents liquides à travers nos adsorbants a permis une élimination quasi totale de ces matières en suspension (voir Figure 8) [81-85].
Évolution de la demande chimique en oxygène.
La pollution organique représente l'ensemble des matières organiques biodégradables et non biodégradables, qui peuvent générer différents problèmes au niveau des milieux récepteurs : mauvaises odeurs, consommation d’oxygène, dégradation de la faune et de la flore et perturbation des écosystèmes. Il a été rapporté que les cendres volantes, le sable et le sol argileux possèdent des propriétés multifonctionnelles telles que la capacité de rétention et d'adsorption de différents polluants organiques, inorganiques et des métaux lourds (voir Figure 9).
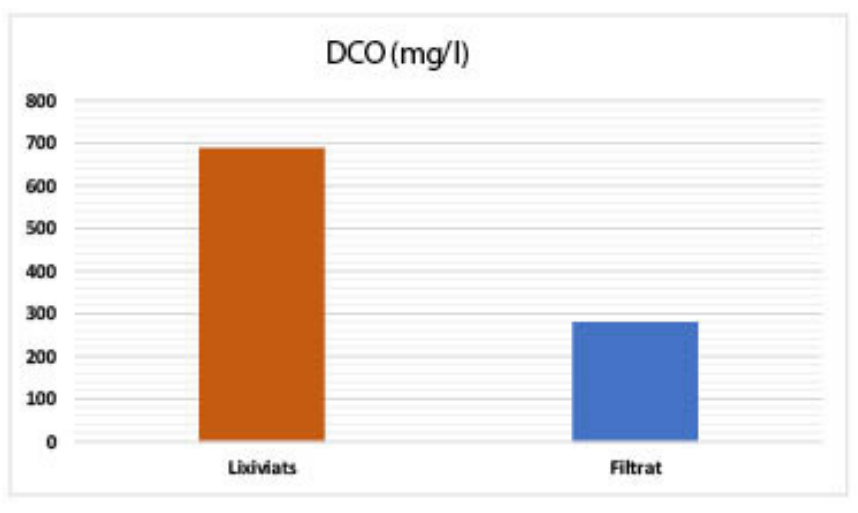
La majeure partie de la matière organique soluble et particulaire contenue dans les eaux usées étudiées a été retenue par les différents supports utilisés, avec un taux d’abattement dépassant les 80 %. Cette réduction de la charge organique dissoute indique qu'une bonne assimilation bactérienne prend place dans le lit filtrant. Ceci est lié probablement à une meilleure oxygénation de ce dernier permettant aux bactéries aérobies de proliférer et d’assurer en conséquence une meilleure minéralisation ou oxydation de la matière organique. L’abattement et l’élimination de la DCO font intervenir des phénomènes physiques de sédimentation et de filtration ainsi que des phénomènes biologiques de dégradation et de décomposition de la matière organique particulaire et dissoute associés à la flore bactérienne du lit filtrant [86-87].
Évolution des chlorures.
Les rejets étudiés sont également trop chargés en ions chlorures avec des valeurs dépassant les 700 mg l-1. L’élimination des anions chlorures (voir Figure 10) peut être expliquée par la présence des cations contenus dans les différents supports filtrants utilisés et qui piègent ces ions par adsorption ou par échange d’ions. C’est le cas des cendres volantes qui sont connues comme des matériaux naturels présentant une bonne capacité d'échanges d’ions et un pouvoir d’adsorption et d’élimination de plusieurs polluants de l’eau.
Évolution du phosphore.
Le phosphore est l'un des principaux éléments nutritifs qui provoquent l’eutrophisation, phénomène qui se traduit par une prolifération excessive des algues et des cyanobactéries toxiques dans les milieux aquatiques. Plusieurs formes de phosphore sont rencontrées dans les eaux usées, mais les orthophosphates étant les espèces de phosphore les plus abondantes. Les eaux usées étudiées présentent de fortes charges en orthophosphates dont la valeur dépasse la norme marocaine d'un rejet avant déversement dans le milieu récepteur (60 mg l-1 en orthophosphates).
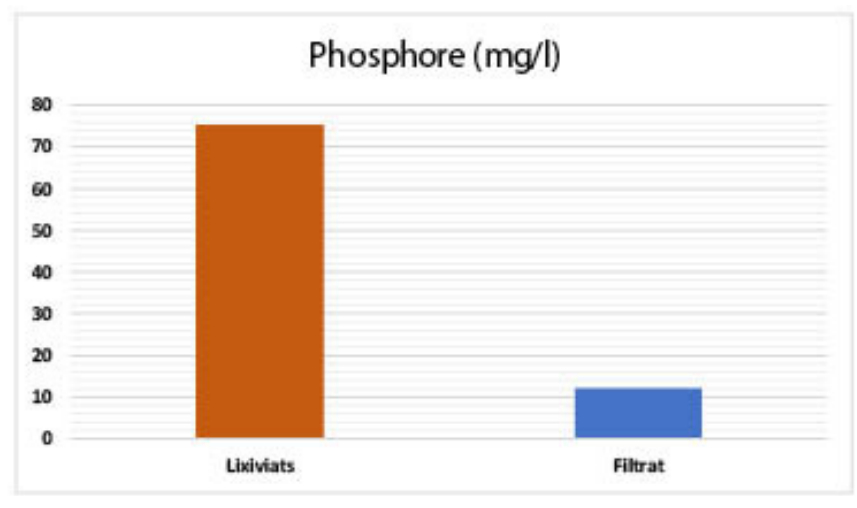
(voir Figure 11). Après filtration sur les différents supports argileux nous avons noté un taux d’élimination très significatif ce qui peut être expliqué par l'adsorption du phosphore sur les argiles utilisées ou sa précipitation avec le fer, le calcium ou l’aluminium, éléments constituants les feuilles des matrices argileuses composant le lit filtrant [88-90].
Évolution de l’ammonium.
Habituellement la présence des ions ammonium dans l’eau traduit un processus de dégradation incomplet de la matière organique. Les eaux usées étudiées présentent une concentration en ions ammonium dépassant les 60 mg/l. En excès, ces ions peuvent avoir un impact sur la faune et la flore des milieux récepteurs. Après passage à travers le sable, les cendres volantes et le sol argileux, nous avons constaté un taux d’élimination des ions ammonium dépassant les 90 % (voir Figure 12) [91-92].
CONCLUSION
Le potentiel des ressources en eau est évalué à 22 milliards m³ par an, soit l'équivalent de 750 m³/habitant/an, communément admis comme seuil critique indiquant l'apparition de pénuries et de crise latente d'eau. Plus de la moitié de ces ressources sont concentrées dans les bassins du nord et le Sebou couvrant près de 7 % du territoire national. À cette limitation des ressources en eau s’ajoute la dégradation de la qualité de l’eau suite à l’augmentation de la pollution. Dans ce contexte et pour accompagner le développement du pays, le Maroc s'est engagé depuis longtemps dans la voie de la maîtrise de ces ressources en eau à travers la réalisation de 135 grands barrages totalisant une capacité de près de 17,5 milliards de m³ et de plusieurs milliers de forages et de puits captant les eaux souterraines. Toutefois, le secteur de l’eau reste confronté à des défis liés principalement à la raréfaction des ressources en eau sous l’effet des changements climatiques, à la sur-exploitation des ressources en eau souterraine, à la faiblesse de la valorisation des ressources en eau mobilisées notamment dans le domaine agricole et à la détérioration de la qualité des ressources en eau à cause du retard dans l’assainissement, l’épuration des effluents liquides et la réutilisation des eaux usées épurées.
Les méthodes de purification des effluents liquides sont multiples, mais celle d’infiltration-percolation reste la plus utilisée et la plus efficace, grâce à sa simplicité, son coût d’exploitation, et particulièrement son rendement épuratoire. Dans cet objectif, nous avons utilisé l’infiltration-percolation en utilisant une matrice purifiante formée de sable marin de taille granulométrique 100 µm, de cendres volantes et de sol argileux. Les abattements obtenus sont très significatifs car ils dépassent les 80 % pour tous les paramètres physico-chimiques étudiés. Le filtrat récupéré est parfaitement dans les normes pour l'irrigation.
Notre prochaine recherche sera consacrée d'une part à l’étude de l’évolution des traces des métaux lourds avant et après filtration à travers les mêmes adsorbants et d’autre part à la valorisation de la boue de filtration récupérée dans le domaine du génie civil. ©
Références bibliographiques
LAAMYEM A, HAFFAD H, NAJEM M. Caractérisations physiques et chimiques des eaux usées industrielles après filtration à travers la matrice sol-sable en fonction de la taille granulométrique. Revue EIN 343, pp. 85-88.
TAOUFIQ L, LAAMYEM A, MONKADE M, ZRADBA A, ELHACHMI E. Utilisation des déchets solides avec du sable pour le traitement des eaux usées de la zone industrielle de la ville de Tanger. Revue EIN 389, pp. 83-88.
LAAMYEM A, BEN ABDELLAH A, ESSADIQI E, FAQIR M, BOUYA M. Filtration et réutilisation des rejets liquides des machines à laver par infiltration-percolation à travers la matrice sable-cendre. Revue EIN 374, pp. 100-105.
EL FADEL H, MERZOUKI M, BENLEMLIH M, LAAMYEM A, NAJEM M. Contribution au traitement par infiltration-percolation des lixiviats de la décharge publique contrôlée de la ville de Fès au Maroc. Revue EIN 341, pp. 85-93.
NAJEM M, LAAMYEM A, LANCAR J T. Rétention des métaux lourds des eaux usées industrielles par filtration-percolation à travers une couche sol-sable. Revue EIN 327, pp. 92-96.
LAAMYEM A, NAJEM M, MONKADE M, ZRADBA A, RADOUANI N. Revalorisation des cendres volantes dans le traitement des eaux usées industrielles de la ville d’El Jadida. Revue EIN 332, pp. 101-104.
BHATNAGAR A, SILLANPÄÄ M. Applications of chitin- and chitosan-derivatives for the detoxification of water and wastewater. Colloid Interface Sci. 2009, p. 26-38.
LAAMYEM A, BEN ABDELLAH A, ESSADIQI E, FAQIR M et BOUYA M. Rétention des métaux lourds des eaux de refroidissement industrielles par filtration-percolation à travers des matrices filtrantes naturelles. Revue EIN 373, pp. 91-96.
CHAOUITE J, MONCEF M, LAAMYEM A, NAJEM M. Approche analytique des éléments majeurs, micro-nutriments et métaux lourds dans les eaux de la lagune et des salines de Oualidia (zone humide du Sahel côtier atlantique, Doukkala, Maroc) par spectrométrie de plasma ICP-MS (2ᵉ partie). Revue EIN 365, pp. 107-115.
SCHNITZER M., KAHN S.H. Humic substances in the environment. Marcel Dekker, New York, 1972, p. 204.
CHAPMAN D. Water quality assessment. A guide to the use of biota, sediments and water in environmental monitoring. Londres, 1992.
COBB D.G., FLANNAGAN J. Effects of discharge and substrate stability on density and species composition of stream insects. J. Sci. Halieutiques, 1996, pp. 1788-1795.
RODIER J. Analyse de l'eau naturelle, eaux résiduaires, eau de mer. 8ᵉ éd. Dunod, Paris, 1996, vol. 1, p. 1383.
ZH H.M., WANG B. Multifunctional micronized modified kaolin and its application in wastewater treatment. Hazardous Materials, 2006, pp. 365-370.
ESSA M., FARRAGALLAH M. Clay minerals and their interaction with heavy metals and microbes of soils irrigated by various water resources. Envir. Res. 2006, pp. 73-90.
SHEN Y.H. Phenol sorption by organoclays having different charge characteristics. Physico-chemical, 2004, vol. 232, pp. 143-149.
WEBER M., WESTFALL D. Ammonium adsorption by a zeolite in a static and a dynamic system. J. Environ. Qual. 1983, vol. 12, p. 549-552.
BURAGOHAIN D., SREDEEP S., SAIYOURI N. A study on the adsorption of ammonium in bentonite and kaolinite. JCEBS, 2013, pp. 2320-4087.
HAMMER M.J., HAMMER J.R. Water and wastewater technology. 4ᵉ édition. Prentice Hall of India, New Delhi, 2005.
DUCHAUFOUR P. Abrégé de pédologie : sol, végétation et environnement. 5ᵉ édition, Masson, 1997.
COMITE NORMES ET STANDARDS. Ministère de l’Environnement du Maroc, Rabat, 1994.
FURUMAL H., KHAKI S. Adsorption-desorption of phosphate by lake sediment under anaerobic conditions. Wat. Res. 1989, vol. 23, pp. 677-683.
WIELAND E., STUMM W. Dissolution kinetics of kaolinite in acidic aqueous solutions at 25 °C. Geochimica.
WENCONG Y., YANPENG C., QIANGQIANG R., CHUNHUI L., LIJUAN R. A hybrid life-cycle and fuzzy-set-pair analyses approach for comprehensively evaluating impacts of industrial wastewater under uncertainty. Cleaner Production, 2014, pp. 57-68.
DANIAU C., DOR F., EILSTEIN D., EMPEREUR-BISSONNET P., DAB W. Étude de la santé déclarée par les personnes riveraines de sources locales de pollution environnementale. Epidémiologie et Santé Publique, 2013, vol. 61, pp. 388-398.
KAIMOUSSI A., CHAFIK A., MOUZDAHIR A., BAKKAS S. Impact de la pollution industrielle sur la zone côtière du Jorf Lasfar : la moule comme indicateur de la contamination métallique. Earth and Planetary Science, 2001, vol. 333, pp. 337-341.
HENNO J. Mieux recycler les eaux usées pour lutter contre la pénurie. Les Echos, vol. 30, p. 23.
BAIOUMY H. Source and origin of sedimentary kaolin deposits in Egypt. Meeting of the Clay Minerals Society, Montana, June 2009, pp. 5-11.
ABDELKHALEK N. The Egyptian kaolin : an outlook in the view of the new climate of investment. Applied Clay Science, vol. 15, 1999, pp. 325-336.
ABDALLAH S., MAHDY R. Characterization of some clay sediments in Egypt for safe environmental applications. Basic and Applied Sciences, 2007, vol. 4, pp. 813-823.
RASHED M.N., SOLTAN M.E. Removal of heavy metals from urban wastewater using aeration, alum and kaolin. Hydrology, No. 45, UNESCO, Paris, 2001.
BHATTACHARYYA K.G., GUPTA S.S. Adsorption of a few heavy metals on natural and modified kaolinite. Colloid Interface Sci. 2008, vol. 5, pp. 14-31.
SUSMITA S.G., KRISHNA G. Adsorption of heavy metals on kaolinite, montmorillonite. Physical Chemistry, 2012, p. 12.
MULLINS G., MITCHELL C. Wheat forage response to tillage and sulfur applied as phosphogypsum. Orlando, publication FIPR, 1990, vol. 1, pp. 361-375.
MOUTAOUAKIL A., PINEAU J.L., LAHLOU K. La recherche d’un procédé viable de valorisation d’un phosphogypse provenant de l’industrie phosphatière marocaine. Déchets Sciences et Techniques, 2003, vol. 29, pp. 31-35.
KOULOHERIS A.P. Chemical nature of phosphogypsum as produced by various wet phosphoric acid processes. First International Symposium on Phosphogypsum, publication, Florida, 1980, pp. 5-7.
MARIA V., LUMINITA I., ANCA D. Fly ash adsorbents for multi-cation wastewater treatment. Applied Surface Science, 2012, vol. 258, pp. 6345-6352.
MUZZARELLI R. Chitin nanostructures in living organisms. In : Chitin Formation and Diagenesis. GUPTA S.N. (éd.), Springer, New York, 2010.
SANDFORD P.A. Chitin and chitosan : physical properties and applications. Elsevier Applied Science, 1989, pp. 51-69.
KNORR D. Dye binding properties of chitin and chitosan. J. Food Sci., 1983, pp. 36-41.
KIM C.Y., CHOI H.M., CHO H.T. Effect of deacetylation on sorption of dyes and chromium on chitin. J. Appl. Polym. Sci., 1997, vol. 63, pp. 725-736.
NO K., LEE K., MEYERS P. Correlation between physical chemical characters and binding capacity of chitosan products. J. Food Sci., 2000, vol. 65, pp. 1134-1137.
BREMOND R., VUICHARD R. Paramètres de la qualité des eaux. Ministère de la Protection de la Nature et de l’Environnement, SPEPE, 1973, p. 179.
YUSOF N.L., LIM L.Y., KHOR E. Flexible chitin films : structural studies. Carbohydr. Res., 2004, vol. 339, pp. 2701-2711.
ACOSTA N., ARANAZ I., PENICHE C., HERAS A. Tramadol release from a delivery system based on alginate-chitosan microcapsules. Macromol. Biosci., 2003, vol. 3, pp. 546-551.
PENICHE C., PENICHE H., ACOSTA N. Chitosan : an attractive biocompatible polymer for microencapsulation. Macromol. Biosci., 2003, vol. 3, pp. 511-520.
BHATNAGAR A., SILLANPÄÄ M. Applications of chitin- and chitosan-derivatives for the detoxification of water and wastewater. Colloid Interface Sci. 2009, p. 26-38.
ABIDIN KAYA, ALI HAKAN OREN. Adsorption of zinc from aqueous solutions to bentonite. Journal of Hazardous Materials, 2005, B125, p. 183-189.
EL GOUAMRI Y. Étude de la qualité physicochimique des eaux usées rejetées dans le lac Fouarat. Africain des Sciences de l’Environnement, 2006, pp. 53-60.
REVIL A., LEROY P., TITOV K. Characterization of transport properties of argillaceous sediments. Journal of Geophysical Research, 2005, vol. 110, B06202.
SANTÉ CANADA. 2003. Recommandations pour la qualité de l'eau potable au Canada : la turbidité. Comité fédéral provincial territorial sur l'eau potable, Ottawa, pp. 36.
SCHNITZER M., S.H. KAHN. 1972. Humic substances in the environment, Marcel Dekker, New York, N.Y., pp. 204.
CHAPMAN D. Water quality assessment. A guide to the use of biota, sediments and water in environmental monitoring. 1992. Londres, Angleterre.
COBB D.G. AND FLANNAGAN J. Effects of discharge and substrate stability on density and species composition of stream insects. J. Sci. Halieutiques. 1996, pp. 1788-1795.
RODIER J. L'analyse de l'eau naturelle, eaux résiduaires, eau de mer, 8e éd. Dunod, Paris, 1996, Vol. 1, pp. 1383.
ZH M., WANG B. Multifunctional micronized modified kaolin and its application in wastewater treatment. Hazardous Materials, 2006, pp. 365-370.
ESSA M., FARRAGALLAH M. Clay minerals and their interaction with heavy metals and microbes of soils irrigated by various water resources. Environ. Res. 2006, pp. 73-90.
SHEN Y.H. Phenol sorption by organoclays having different charge characteristics. Physicochem. 2004, Vol. 232, pp. 143-149.
GUPTA K., MOHAN D. Utilization of bagasse fly ash for the removal and recovery of phenol and p-nitrophenol from wastewater. Biotechnol. 1998, Vol. 71, pp. 180-186.
HEDGE R. AND MCLELLAN M. Archaeometry, 1976, Vol. 18, pp. 203.
WEI-SHENG C., FANG-CHIH C., YUN-HWEI S., MIN-SHING T., CHUN-HAN K. Removal of chloride from MSW fly ash. Hazardous Materials, 2012, pp. 116-120.
MAHMOUD M. AND AHMED M.L. Abatement of free chlorine from water using kaolinite. Environ. Res. 2004, Vol. 7, pp. 237-238.
ERICKSON E., AFFARTH K., HENZE M., A. LEDIN. 2002. Characteristics of grey wastewater, Urban Water, 4, p. 85-104.
UDERT K. AND GUJER W. Urea hydrolysis and precipitation dynamics in a urine-collecting system. Water Res. 2003, pp. 2571-2582.
BONTE S.L., PONS M., POTIER O. AND ROCKLIN P. Relation between conductivity and ion content in urban wastewater. Journal of Water Science, 2008, Vol. 21, pp. 429-438.
PIVATO A. Tests for the evaluation of ammonium attenuation in MSW landfill leachate by adsorption into bentonite. Waste Management. 2006, Vol. 26, pp. 123-132.
WEBER M. AND WESTFALL D. Ammonium adsorption by a zeolite in a static and a dynamic system. J. Environ. Qual. 1983, Vol. 12, p. 549-552.
BURAGOHAIN D., SREDEEP S. AND SAIYOURIN A. A study on the adsorption of ammonium in bentonite and kaolinite. JCEBS, 2013, pp. 2320-4087.
HAMMER M.J., HAMMER JR. 2005. Water and wastewater technology, 4th Edition. Prentice Hall of India, New Delhi.
DUCHAUFOUR P. Abrégé de pédologie : sol, végétation et environnement. 5e Édition, 1997, Masson.
COMITÉ NORMES ET STANDARDS. 1994. Ministère de l'Environnement du Maroc. Rabat.
FURUMAI H., KHAKI S. Adsorption-desorption of phosphate by lake sediment under anaerobic conditions. Wat. Res. 1989, Vol. 23, pp. 677-683.
WIELAND E., STUMM W. Dissolution kinetics of kaolinite in acidic aqueous solutions at 25 °C. Geochimica et Cosmochimica Acta, 1992, Vol. 56, pp. 3339-3355.
XIAOMIN L., YANRU T., XIUJU C., DANDAN L., FANG L., WENJING S. Preparation and evaluation of orange peel cellulose adsorbents for effective removal of Cd, Zn, Co and Ni. Colloids and Surfaces. 2008, Vol. 317, pp. 512-521.
SUANTAK K., S. SURESH, C.B. MAJUMDER AND S. CHAND. Characterization of banana and orange peels: biosorption mechanism, Sci Technology & Management. 2011, Vol. 2.
MAFRA S. Humic acids from hydromorphic soils of the upper Negro river basin, Amazonas: Chemical and spectroscopic characterization. 2006.
ALLAHVERDI A., KANI N.E., YAZDANIPOUR M. Effects of blast-furnace slag on natural pozzolan-based geopolymer cement. Ceramics. 2011, Vol. 55, pp. 68-78.
TCHAKOUTÉ K. AND NJOPWOUO D. The effect of adding alumina-oxide to metakaolin and volcanic ash on geopolymer products. Construction and Building Materials. 2012, Vol. 35, pp. 960-969.
HASSEN S., ANNA Z., ELALOUI E.E., BELGACEM M., MAURET E. Study of the valorization of phosphogypsum as filler in paper. Sci and Engineering. 2012, Vol. 27.
SEHCHI M., MASARU M., REIKICHI AND I., SUSUMU Y. Journal of Applied Polymer Sciences. 1983, Vol. 28, pp. 1909-1917.
SHAOUJIE L., S. XUEFENG, DEYONG C., YIPING C. AND KANGDE Y. Preparation of water-soluble chitosan. Polymer Science. 2003, Vol. 91, no. 6, pp. 3497-3503.
GOW N., GOODAY G., RUSSELL G., WILSON J. Infrared and X-ray diffraction data on chitins of variable structure. Carbohydr. Res. 1987, Vol. 165, pp. 105-110.
PENICHE C., ARGUELLES-MONAL W., DAVIDENKO N., SASTRE R., GALLARDO A., SAN ROMAN. Journal of Biomaterials. 1999, Vol. 20, pp. 1896.
JUN Z., YOULING Y., JIAN S., SICONG L. European Polymer. 2003, Vol. 39, pp. 847-850.
KASSAI M.R. Several reported procedures to determine the degree of N-acetylation for chitin and chitosan using IR. Carbohydrate Polymers. 2008, Vol. 71, pp. 497-508.
CRINI G., BADOT M. Chitine et chitosane. Préparation, propriétés et principales applications. Presses universitaires de Franche-Comté. 2009, pp. 19-54.
EL HARMOUDI H., EL GAINI L., DAOUDIE E., RHAZI M., BOUGHALEB Y., EL MHAMMEDI M., MIGALSKA A., BAKASSE M. Removal of 2,4-D from aqueous solutions by adsorption processes using two biopolymers: chitin and chitosan and their optical properties. Optical Materials. 2014, Vol. 36, pp. 1471-1477.
JEMAI S., BEN HAJ AMARA A., BEN BRAHIM BEN J., PLANGON A. Étude structurale par RX et IR des hydrates de kaolinite. Applied Crystallography. 1999, pp. 968-976.
MING H. Modification of kaolinite by controlled hydrothermal deuteration – a DRIFT spectroscopic study. Clay Minerals. 2004, Vol. 39, pp. 349-362.
QTAITAT A.M., AL-TRAWNEH N.I. Characterization of kaolinite of the Baten El-Ghoul region/south Jordan. Spectrochimica Acta Part A. 2005, Vol. 61, pp. 1519-1523.
SAIKIA J.B. AND PARTHASARATHY G. Fourier transform infrared spectroscopic characterization of kaolinite. Modern Physics. 2010, pp. 206-210.
BEN FREDJ I. AND MIHOUBI D. Séchage par infrarouge de la bentonite et du kaolin. Revue des Énergies Renouvelables SMSTS'08 Alger. 2008, pp. 79-88.