La qualité sanitaire de la Seine s’est améliorée significativement au cours de ces dernières années grâce à l’amélioration des performances du système d’assainissement par temps sec et par temps de pluie. Son ouverture au grand public pour la baignade est une question d’actualité. Dans le cadre de la surveillance de la qualité microbiologique de la Seine pour une gestion active, il peut être nécessaire de disposer d’un outil de quantification rapide et autonome, tel que le « Système ALERT » de fluidion. Ce dispositif est un analyseur microbiologique pour la quantification in situ des bactéries indicatrices d’une contamination fécale : les Escherichia coli (E. coli). Le système effectue le prélèvement de l’échantillon dans le milieu aquatique, le mélange avec un bioréactif, l’incubation et les mesures optiques, et transmet les informations en temps réel vers une interface Web sécurisée. Cet article présente l’étude de validation de ce système, réalisée dans le cadre d’un partenariat entre le SIAAP et fluidion. Une campagne de mesures contradictoires, réalisée par des laboratoires accrédités, a permis de comparer le Système ALERT avec les méthodes réglementaires. Les résultats obtenus lors de l’étude en laboratoire montrent que la quantification donnée par le Système ALERT est comparable aux résultats obtenus avec les méthodes réglementaires, et cela pour une large gamme de concentrations.
En agglomération parisienne, l’amélioration des performances du système d’assainissement, en termes de collecte, de qualité de traitement en station d’épuration et de gestion des eaux pluviales, a permis d’améliorer la qualité physico-chimique et microbiologique des eaux de surface. En particulier, les 15 dernières années (2000-2015), durant lesquelles des efforts ont été consentis pour généraliser le traitement de l’azote et du phosphore sur les usines et pour limiter les rejets urbains par temps de pluie, ont permis de limiter significativement les flux de micro-organismes introduits dans le milieu naturel. Cette réduction notable a conduit à une amélioration significative de la qualité bactériologique des eaux de Seine.
Cette évolution positive est illustrée sur la figure 1 présentant l’évolution des concentrations médianes en Escherichia coli (E. coli, NPP/100 ml) d’amont en aval de l’agglomération parisienne pour trois périodes : 1999-2001, 2004-2005 et 2011-2013. En 15 ans, le niveau de contamination microbiologique a diminué d’un facteur 2 en amont de l’agglomération parisienne (site de Choisy) et d’un facteur supérieur à 10 en aval de l’agglomération (site de Poissy) (Rocher et Azimi, 2016).
Cette amélioration de la qualité sanitaire des eaux de Seine conduit aujourd’hui à se poser la question de l’autorisation de la baignade sur certains secteurs, notamment dans le cas de l’organisation d’évènements sportifs. À ce jour, la réglementation relative à la baignade (Arrêté du 22 septembre 2008, modifié par l’arrêté du 4 octobre 2011) porte sur deux bactéries indicatrices de contamination fécale : E. coli (seuil fixé à 900 NPP/100 ml, calcul du 90e percentile) et entérocoques intestinaux (seuil fixé à 330 NPP/100 ml, calcul du 90e percentile).
Le suivi et l’évaluation de la qualité sanitaire des eaux de surface deviennent des enjeux majeurs pour les différents acteurs régionaux (SIAAP, Ville de Paris, départements, etc.). Le SIAAP s’est notamment doté d’un outil de suivi de la qualité de la Seine en agglomération parisienne : le réseau MeSeine (Mesures en Seine). Il s’agit d’un réseau de mesure à large spectre qui intègre un suivi de la qualité des eaux superficielles sous l’angle de la physico-chimie, de la bactériologie, de la micro-contamination et du biotope. Le suivi de la qualité bactériologique (E. coli et entérocoques intestinaux) est bimensuel et déployé sur 14 sites d’amont en aval de l’agglomération parisienne, depuis Choisy-Le-Roi dans le Val de Marne jusque Triel-Sur-Seine dans les Yvelines. À ce jour, le suivi est réalisé grâce à des campagnes de prélèvements et des analyses faites en laboratoire, conduisant à des délais relativement importants entre le prélèvement et le rendu du résultat. Ce délai, tout à fait acceptable dans le cadre d’un suivi qualitatif, devient problématique lorsqu’il s’agit de faire une évaluation de la qualité sanitaire en lien avec l’organisation d’une manifestation nautique.
La surveillance en permanence de la qualité microbiologique de l’eau permet aux autorités sanitaires de maîtriser les risques liés aux contaminations bactériennes dans le milieu aquatique. Pour faciliter la communication des résultats entre tous les interlocuteurs concernés, les méthodes de quantification sont normalisées. Tout d’abord, la norme NF EN ISO 8199 décrit de manière générale les techniques et les matériels utilisés pour effectuer les analyses microbiologiques en laboratoire. Ensuite, selon le type de bactérie, une méthode de quantification normalisée explique le protocole de réalisation de l’analyse et l’expression des résultats. Ainsi, toutes les analyses effectuées selon la méthode dite « de référence » pour un type de bactérie donné, sont comparables entre elles (Maux & Simonart, 2010).
Les E. coli sont les bactéries d’intérêt pour qualifier l’état microbiologique de l’eau. Indicatrices d’une contamination fécale récente dans l’eau, la quantification de ces bactéries peut être réalisée selon deux méthodes : NF EN ISO 9308-2 utilisant le Quanti-Tray® de IDEXX Laboratories et la méthode miniaturisée NF EN ISO 9308-3 utilisant une micro-plaque (la plus pratiquée par les laboratoires accrédités). Les deux sont basées sur la méthode statistique du Nombre le Plus Probable (NPP). Selon la provenance de l’échantillon, un nombre de dilutions est réalisé et est réparti dans les puits d’un support spécifique : sachet plastique, ou plaque à 96 micro-puits. Un milieu de culture spécifique permet le développement de la fluorescence en cas de présence des E. coli. Après une incubation de minimum 18 h à 36 °C (Quanti-Tray®) ou 36 h à 44 °C (micro-plaque), le support est révélé sous UV et le nombre de puits fluorescents positifs est relevé. Supposant que la densité des E. coli répond à une distribution de Poisson dans les volumes ensemencés, le résultat ainsi que les limites supérieures et inférieures de l’intervalle de confiance à 95 % sont exprimés en
NPP/100 ml. Un élément à prendre en considération est le fait qu’en utilisant cette méthode, les particules ou agglomérats sont comptés comme une seule bactérie, soit un seul puit allumé.
Dans le cadre de la surveillance de la qualité d’une masse d’eau au quotidien, des méthodes rapides alternatives sont nécessaires afin de répondre à un besoin opérationnel avec des temps de réponse plus courts. De nos jours, diverses techniques de quantification des E. coli existent (Lopez-Roldan, et al., 2013 ; Noble & Weisberg, 2005) allant de la simple mesure de la turbidité aux techniques de quantification qPCR utilisant l’amplification de l’ADN par PCR (Polymerase Chain Reaction) (Bergeron, et al, 2011) et en passant par les méthodes enzymatiques utilisant des substrats spécifiques aux E. coli (Heery, et al., 2016 ; Baudart, et al., 2009). Certaines ont été implémentées sur des appareils utilisables sur site et permettent, par exemple, une surveillance de l’eau de boisson en quasi-continu (Nakache, et al., 2000 ; Miles, et al., 2011). La miniaturisation et l’intégration des systèmes fluidiques dans des instruments complexes in situ est un sujet d’actualité, mais le milieu naturel pose des contraintes très importantes (Angelescu, 2011).
Dans ce contexte, le SIAAP, via sa Direction Développement Prospective, et l’équipe R&D de la société fluidion ont engagé un partenariat visant à étalonner et valider un système capable de mesurer en semi-continu des bactéries fécales en rivière. Il s’agit du Système ALERT, qui est un analyseur in situ autonome, capable de quantifier les E. coli, indicatrices d’une contamination récente, présentes dans le milieu. Il effectue automatiquement et directement in situ toutes les étapes nécessaires à la réalisation d’une analyse microbiologique telles que l’échantillonnage, le mélange avec un bioréactif spécifique, l’incubation et le suivi optique multi-spectral (absorbance et fluorescence). Les données obtenues sont transmises en temps réel vers une interface Web (Huynh et al., 2016). Ainsi, il est possible d’émettre des alertes automatiques en cas de dépassement de seuil afin de permettre l’identification rapide d’un épisode de pollution, et permettre une plus grande réactivité de l’opérateur.
Cet article présente l’étude de validation du Système ALERT en tant qu’analyseur pour mesurer la qualité microbiologique des eaux de surface. La première partie présente les caractéristiques du Système ALERT, la méthode de quantification utilisée, l’étalonnage initial de laboratoire et le cadre de l’étude. La deuxième partie se concentre sur l’établissement d’une nouvelle courbe d’étalonnage spécifique à la matrice de l’eau de Seine, et à l’étude de comparaison avec les mesures contradictoires réalisée par les laboratoires accrédités.
Matériel et méthodes
.jpg)
Description technique du système ALERT
Le système, ayant un corps cylindrique en PVC de dimension D 25 cm x L 40 cm et un poids total de 9,3 kg, fonctionne sur batterie et est entièrement étanche (figure 2). Déployé dans le milieu, il réalise automatiquement et de façon autonome jusqu’à sept prélèvements et analyses microbiologiques indépendantes dans des bioréacteurs individuels. Chaque bioréacteur permet le prélèvement d’un échantillon d’eau, le mélange avec du bioréactif, l’incubation à une température contrôlée de 37 °C, le suivi des caractéristiques optiques de l’échantillon (absorbance et fluorescence) et la transmission sans fil des données. Un microprocesseur embarqué contrôle les modules d’échantillonnage, d’incubation et de mesure optique ; aussi, il collecte, stocke les données des mesures et transmet les informations en temps réel au serveur central fluidion via le réseau GSM ; finalement, le Système ALERT peut être configuré et opéré depuis un téléphone portable ou via l’interface Web sécurisée.
Chaque bioréacteur est composé (1) d’un flacon d’échantillonnage relié, moyennant un adaptateur d’échantillonnage, à un tube de prélèvement, (2) d’une gaine de chauffage asservie à un contrôleur de température et (3) d’une carte opto-électronique en forme d’anneau réalisant les mesures spectrophotométriques à travers le flacon (figure 3). Un capteur de température est positionné contre la gaine de chauffage pour un contrôle précis de l’incubation. Trois LED et une photodiode permettent la réalisation des mesures d’absorbance et de fluorescence, et un filtre UV élimine les interférences dues à l’excitation de la fluorescence.

Après avoir réalisé les sept analyses disponibles, une maintenance doit être réalisée. Grâce à un kit de maintenance prévu, elle peut être réalisée directement sur le terrain par un technicien formé et dure moins de 30 minutes. Le kit contient les éléments propres de remplacement (flacons stériles et adaptateurs), les solutions de nettoyage, le bioréactif, une batterie de rechange chargée et tous les outils nécessaires. Les tubes de prélèvement et les clapets anti-retour sont décontaminés, sur site, avec la solution de nettoyage, rincés avec de l’eau stérile et puis séchés. Le bioréactif fourni est conditionné dans une seringue qui permet un dosage facile dans les flacons stériles. L’appareil est par la suite fermé hermétiquement permettant l’installation pour une nouvelle campagne de sept analyses. Deux types de supports d’installation sont disponibles pour une installation directement dans le milieu (comme une bouée flottante), ou ancré à une structure (par exemple dans un bac de prélèvement).
Principe de mesure et d’étalonnage du Système ALERT
La méthode de quantification utilisée dans le Système ALERT est basée sur la technique « Defined Substrate Technology ». Elle est spécifique aux E. coli mais aussi aux Coliformes totaux (CT) qui ne seront pas abordés ici. Basé sur le développement d’une activité enzymatique, le bioréactif contient un milieu de culture spécifique et également les substrats ONPG (ortho-nitrophenyl-ß-galactoside) et MUG (4-methylumbelliferyl-ß-D-glucuronide) qui sont respectivement spécifiques aux enzymes de CT et E. coli. La ß-galactosidase, l’enzyme présente sur les CT, hydrolyse l’ONPG pour produire l’ONP (ortho-nitrophenol), composé de couleur jaune, alors que la ß-glucuronidase, présente sur les E. coli, transforme le MUG en MUF (4-methylumbelliferyl), un composé fluorescent. Lorsque l’échantillon d’eau à analyser est mélangé avec le bioréactif et ensuite incubé à 37 °C (température idéale pour la croissance des E. coli), l’apparition de ces composés est suivie dans le temps par des mesures spectrophotométriques et de fluorescence (figure 4).
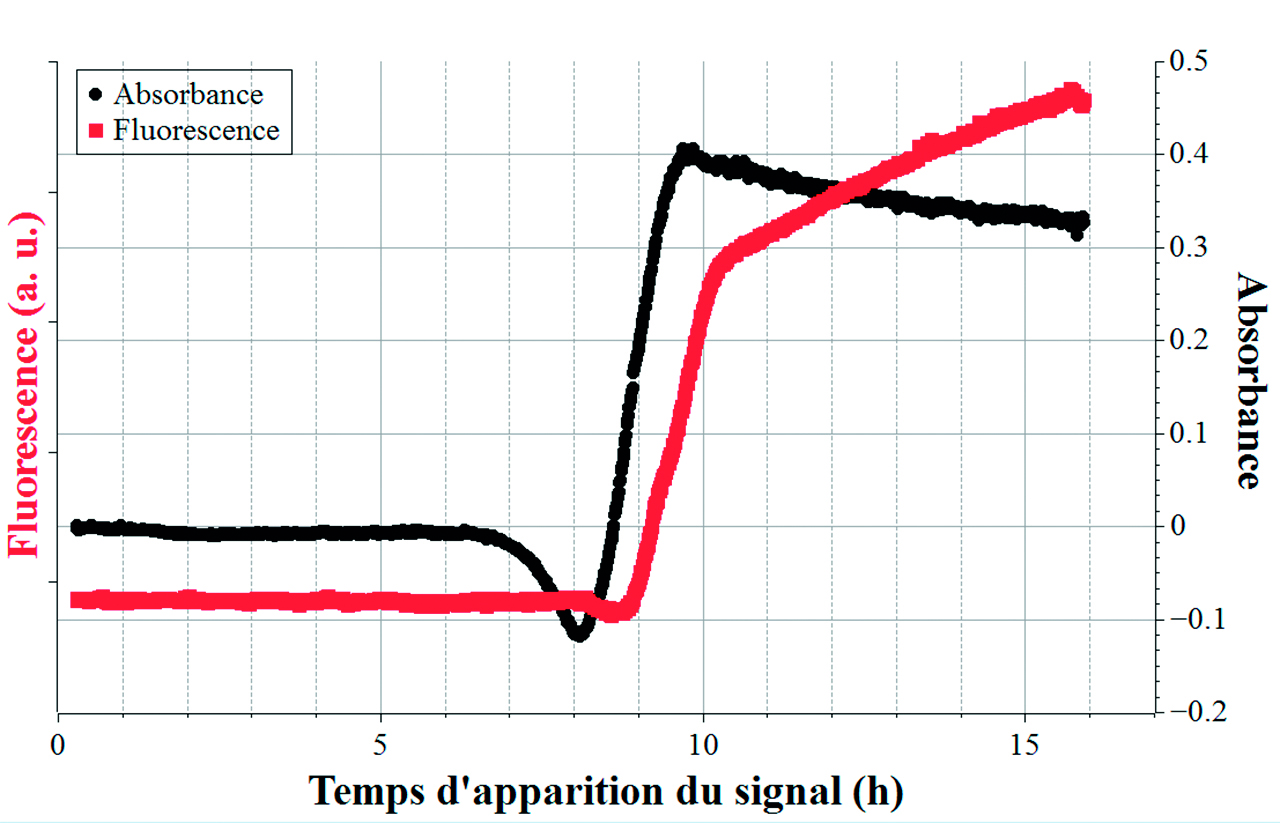
L’absorbance (courbe noire) est mesurée à 430 nm et la fluorescence (courbe rouge) est excitée à 385 nm et mesurée à > 400 nm. Une correction de turbidité est également appliquée pour compenser la diffusion de la lumière induite par la croissance bactérienne. Dans un premier temps, les signaux optiques sont constants au niveau de la ligne de base, correspondant à une absence de production des composés chromogènes et fluorescents. Après un certain temps d’incubation, un signal d’absorbance apparaît correspondant à la libération d’ONP suivi par le signal de fluorescence correspondant au MUF. L’analyse des courbes de la figure 4 permet de mesurer les délais d’apparition des signaux optiques et de les corréler respectivement avec les concentrations de CT et de E. coli.
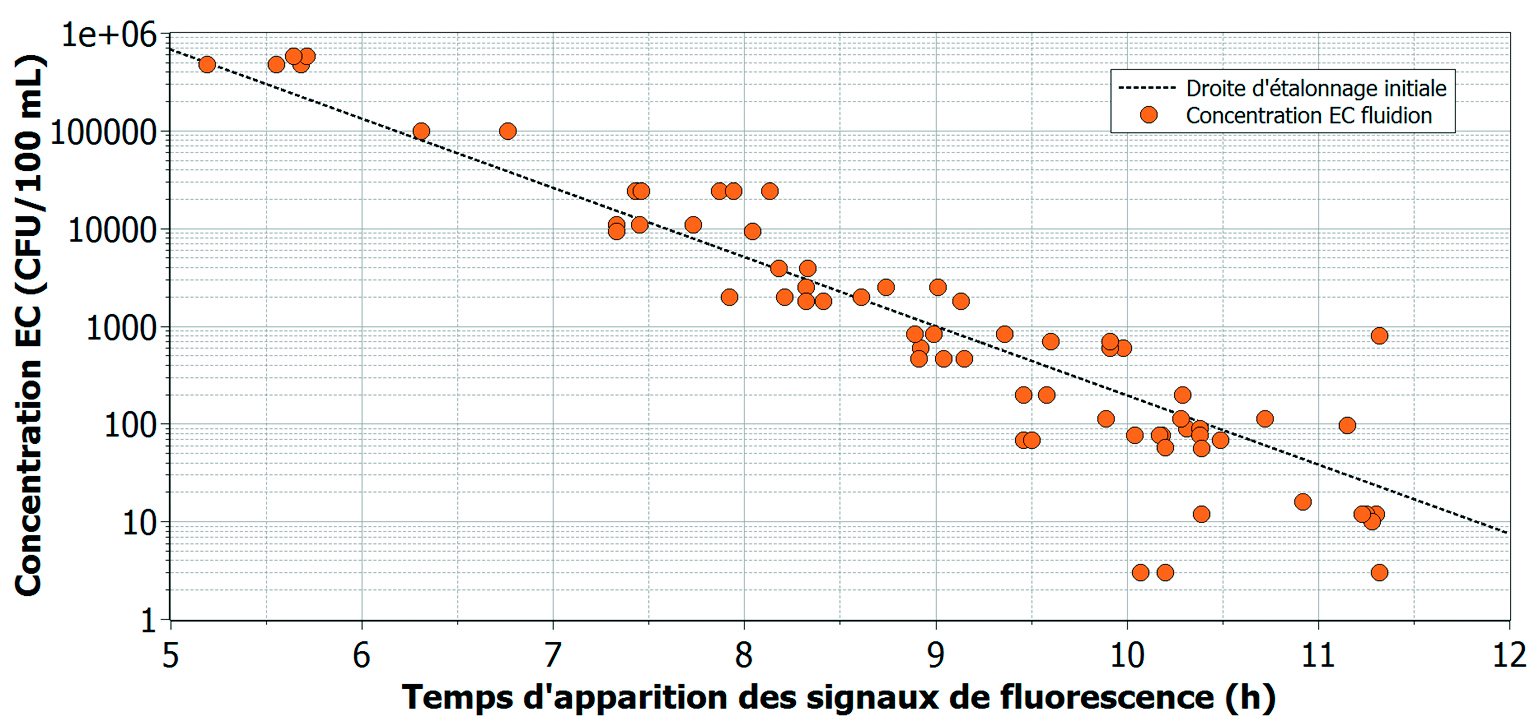
Les temps d’apparition de fluorescence et d’absorbance sont respectivement corrélés à des concentrations de E. coli et de CT en Unités Formants de Colonies par 100 ml (CFU/100 ml). En effet, une courbe d’étalonnage initiale a été préalablement établie en laboratoire pour E. coli et CT. Les souches d’E. coli utilisées (lyophilisées, source : IDEXX Laboratories) ont été mises en culture, et différentes dilutions ont ensuite été réalisées pour atteindre une large gamme de concentrations. Ces solutions ont été analysées avec le Système ALERT en présence du bioréactif. En parallèle, deux méthodes de comptage de colonies ont été utilisées pour obtenir la courbe d’étalonnage initiale : pour les concentrations élevées, le dénombrement se fait par ensemencement direct de 400 µL sur la gélose de TTC-tergitol, tandis que pour les concentrations faibles, le dénombrement se fait après une filtration de 50 ml de solution sur membrane (Sartorius, nitrate de cellulose, pore : 0,45 µm) déposée sur la gélose de TTC-tergitol. Les résultats de l’étalonnage sont représentés sur la figure 5, pour des concentrations couvrant 6 unités logarithmiques. Une droite d’étalonnage peut en être établie, permettant la quantification de E. coli par l’appareil à partir des signaux mesurés.
Descriptif des campagnes de tests en laboratoire
.jpg)
Stratégie expérimentale. Les essais du Système ALERT ont été réalisés lors d’un déploiement dans le centre de recherche du SIAAP de Colombes et ont consisté en la mise en œuvre de mesures contradictoires. L’objectif était de permettre une évaluation complète des performances métrologiques du système de mesure sur une large gamme de concentrations en bactéries fécales et sur une matrice réelle. Pendant une période de 2 mois entre novembre 2016 et janvier 2017, 210 échantillons d’eau de Seine prélevés quotidiennement près du centre de recherche du SIAAP ont été analysés avec le Système ALERT et selon les méthodes normalisées en laboratoire. Deux laboratoires accrédités ont été sollicités pour les analyses : celui du SIAAP (sur site et donc sans transport de l’échantillon) et un laboratoire prestataire externe (avec transport).
Le pool d’échantillons a été construit de manière à avoir des concentrations en bactéries fécales très contrastées ; des concentrations très faibles correspondant à celles observées en rivière durant l’étiage (gamme basse) et plus élevées correspondant à celles pouvant être observées lorsque les précipitations importantes induisent des rejets urbains de temps de pluie (gamme haute). Pour la gamme basse, des mélanges entre de l’eau de surface brute de la Seine (ES) et de l’eau de surface filtrée à 0,45 µm (ES045) ont été effectués. Pour la gamme haute, des mélanges entre de l’eau de surface brute de la Seine (ES) et de l’eau brute (EB) prélevée en réseau d’assainissement (entrée usine Seine Centre, Colombes) ont été effectués. Ce protocole de mesure est présenté schématiquement en figure 6.
Méthodes de référence des laboratoires SIAAP et externe. L’analyse des E. coli a été réalisée par deux laboratoires accrédités, utilisant la même méthode d’analyse miniaturisée de recherche et de dénombrement des E. coli sur microplaque NF EN ISO 9308-3.
- • Laboratoire d’Analyses et Prélèvements de la Direction du Développement et de la Prospective du SIAAP, sous couvert de l’accréditation (laboratoire SIAAP - DDP accréditation COFRAC Essais, n°1-1452, portée disponible sur www.cofrac.fr) ;
- • Laboratoire prestataire externe, sous couvert de l’accréditation (accréditation COFRAC Essais, n°1-1531, portée disponible sur www.cofrac.fr).
Résultats et discussion
Ajustement de la droite d’étalonnage pour la Seine
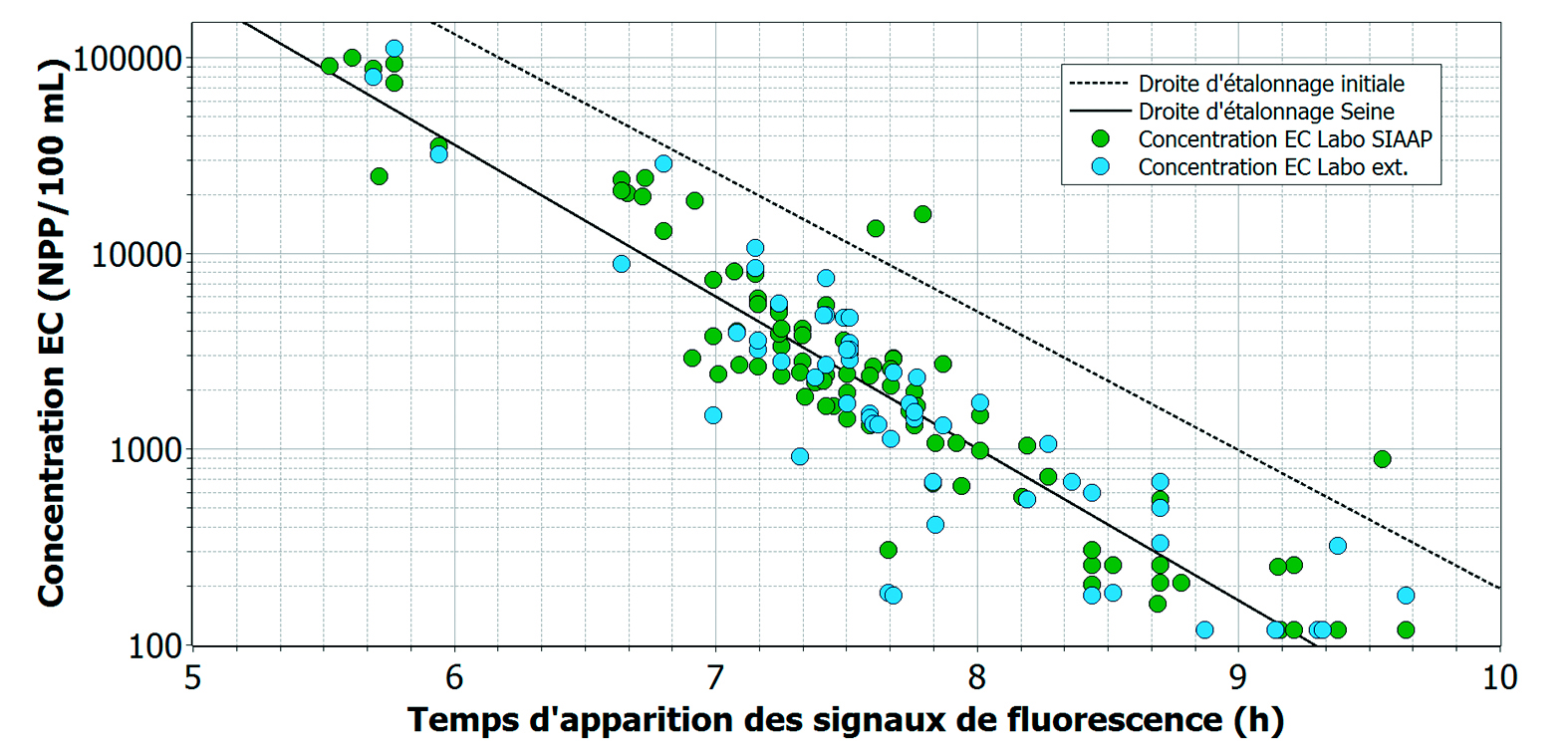
Grâce à la droite d’étalonnage réalisée initialement avec des solutions de différences concentrations bactériennes, le Système ALERT peut déterminer automatiquement, utilisant un algorithme développé en interne, les concentrations de E. coli à partir des courbes d’absorbance et de fluorescence. Cependant, lorsque le système est installé dans un milieu aquatique ayant des compositions physico-chimique et bactériologique très différentes de celles du laboratoire, une différence et donc un réétalonnage avec la matrice réelle peut s’avérer nécessaire afin d’obtenir des résultats plus représentatifs du milieu réel.
Des solutions de différentes dilutions faites à partir d’eau de Seine et d’eau brute ont été préparées à l’échelle du laboratoire (SIAAP) et ont permis d’atteindre toutes les concentrations qu’il est probable de rencontrer dans la Seine. Elles ont été analysées par le Système ALERT pour déterminer leurs temps d’apparition d’absorbance et de fluorescence et ont été quantifiées par les deux laboratoires accrédités (SIAAP et externe) en utilisant la méthode de référence (figure 6). Sur ces échantillons analysés, les concentrations ont été maîtrisées et le transport des échantillons éliminé (cas pour les échantillons analysés par le SIAAP). Ces deux critères ont donc augmenté la précision de l’étalonnage. Grâce aux résultats obtenus, il a été possible d’établir une nouvelle droite d’étalonnage adaptée à la matrice de l’eau de Seine. Sur la figure 7, il est possible d’observer un écart entre la droite d’étalonnage initiale (ligne pointillée) et la nouvelle droite correspondante à la matrice Seine (ligne pleine). En milieu réel, les temps d’apparition du signal de fluorescence sont détectés plus tôt. Par exemple, pour des concentrations de l’ordre de 2000 NPP/100 ml, le temps d’apparition de la fluorescence passe de 8,5 h à 7,6 h. Ce temps de réponse étant écourté, il peut être imaginable d’avoir des alertes plus tôt pour permettre une plus grande réactivité.
Cette nouvelle courbe d’étalonnage (Seine) a été appliquée par la suite dans toute la présentation des données du Système ALERT, y compris pour l’étude statistique.
Résultats des campagnes de tests en laboratoire
Comparaison entre le Système ALERT de fluidion et les méthodes de référence
L’analyseur a été utilisé dans le laboratoire et par le personnel technique du SIAAP, et les échantillons de la gamme haute (dilutions d’eau brute) et de la gamme basse (dilutions d’eau de Seine) ont été analysés par le Système ALERT, le laboratoire SIAAP, et le laboratoire externe prestataire. Il est important de noter que, pour les résultats du laboratoire externe, les temps supplémentaires de transport ajoutent un facteur possible de dégradation de l’échantillon, qui n’a pas pu être contrôlé dans l’étude.
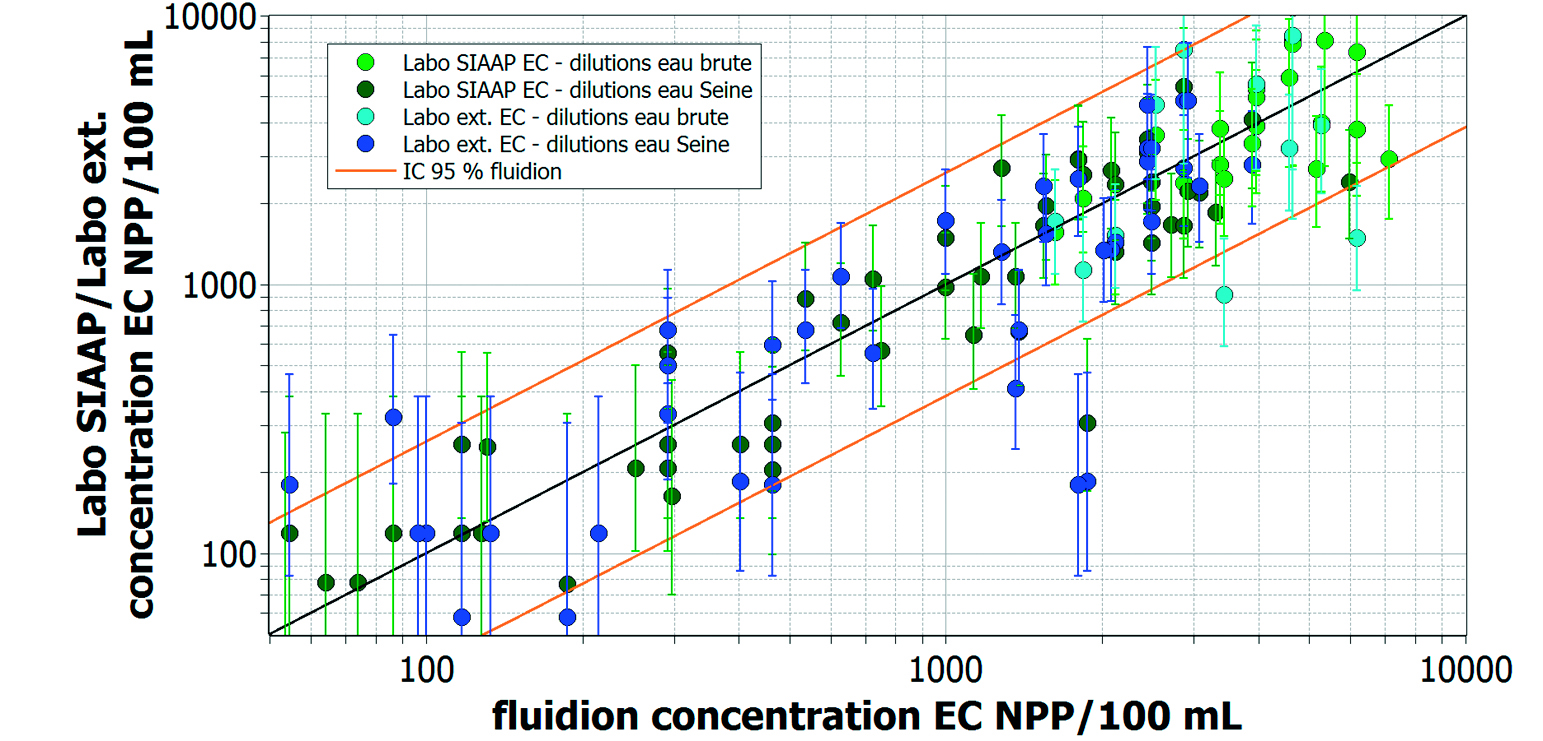
Les données obtenues avec le Système ALERT ont été comparées avec les analyses contradictoires faites par le SIAAP et le laboratoire externe. Ces résultats, représentés sur la figure 8, montrent une répartition homogène des données autour de la droite de corrélation parfaite (droite noire). Le calcul du coefficient de corrélation linéaire révèle une valeur élevée (0,932) dont la majorité des résultats se trouvent dans les limites de l’intervalle de confiance de 95 % des mesures ALERT (lignes jaunes) attestant une bonne correspondance avec les mesures de référence. Les barres d’erreur correspondant aux mesures de laboratoire représentent les valeurs du 95e percentile rapportées par le logiciel NPP du système de référence. Un point important concernant la comparaison de ces données : les barres d’erreur des mesures de référence représentent uniquement les erreurs statistiques de la méthode de mesure NPP, et ne prennent en compte aucun des autres artefacts provenant de l’échantillonnage, du conditionnement et du transport de l’échantillon, qui peuvent introduire des erreurs au moins aussi importantes. Par contraste, l’intervalle de confiance 95 % du Système ALERT (lignes oranges) comprend tous ces effets confondus.
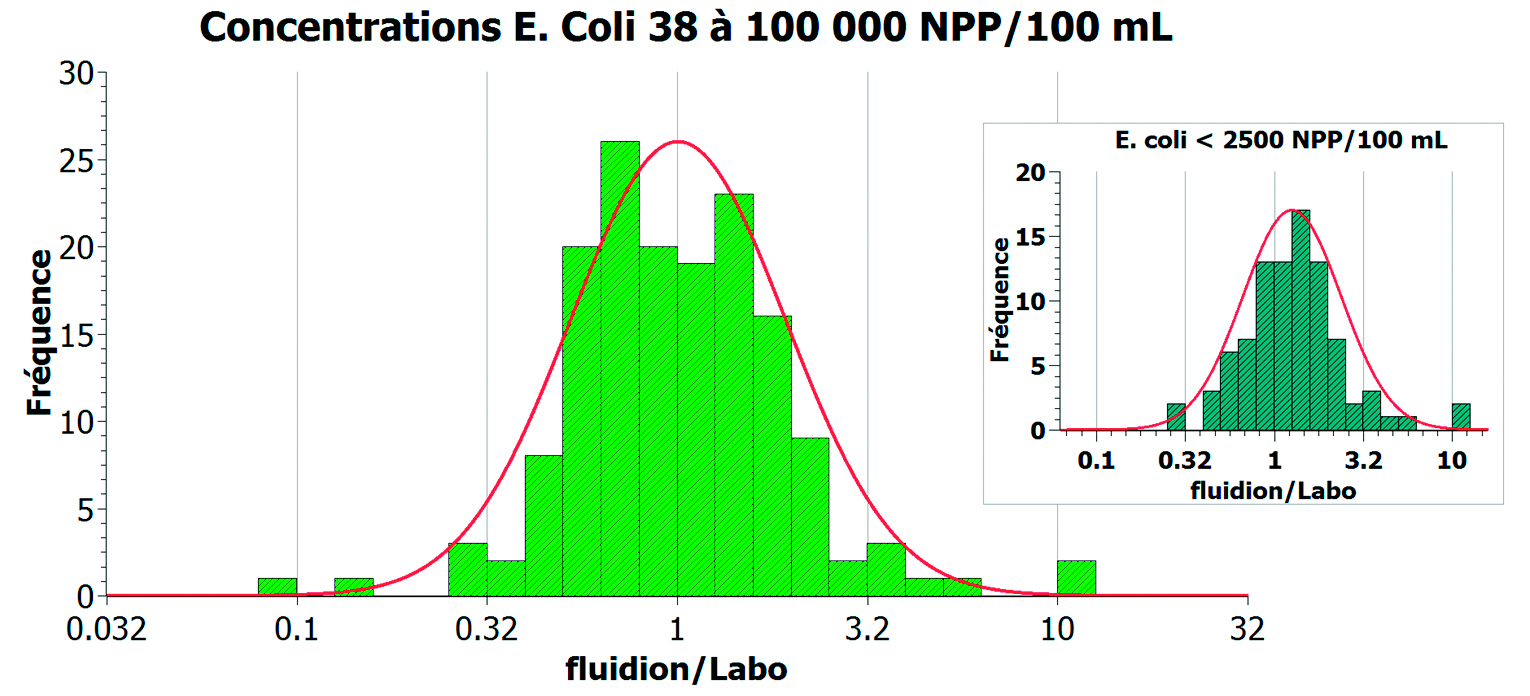
Une étude de la distribution statistique des résultats a également été réalisée. La figure 9 montre l’histogramme de l’écart entre les mesures E. coli du Système ALERT de fluidion et celles des deux laboratoires confondus, exprimé en rapport des deux mesures sur l’ensemble de la gamme de mesures allant de 38 à 100.000 NPP/100 ml. La courbe rouge permet de comparer visuellement l’histogramme obtenu à un profil “en cloche” d’une loi normale. 97 % des points sont écartés de moins d’un facteur 5 par rapport à la valeur de laboratoire, et 79 % des points sont à un facteur d’écart inférieur à 2. L’histogramme est symétrique, témoignant que la mesure par le Système ALERT n’introduit pas d’écart systématique.
Un focus a été effectué sur la gamme basse (entre 38 et 2.500 NPP/100 ml) qui comprend les concentrations sensibles pour la problématique de la baignade dont 900 NPP/100 ml est le seuil à ne pas dépasser (figure 9, encart).
Pour cette gamme basse, l’histogramme de l’écart de mesures entre fluidion et les laboratoires expérimentateurs montre des résultats similaires,
97 % des points sont écartés de moins d’un facteur 5 par rapport à la valeur de laboratoire, et 77 % des points sont à un facteur d’écart inférieur à 2, ce qui illustre bien l’uniformité des mesures, qu’elles soient localisées dans les faibles ou hautes concentrations.
Cohérence intrinsèque des mesures fluidion et des mesures de référence
Pour déterminer la cohérence intrinsèque de la méthode fluidion et celle des méthodes de référence utilisées par les deux laboratoires accrédités (laboratoire SIAAP et laboratoire externe), les concentrations théoriques attendues des trois expérimentateurs pour les solutions diluées en eau brute (gamme haute : CABx) et en eau de Seine (gamme basse : CASx) ont été calculées en fonction des facteurs de dilution (x) et des concentrations mesurées de l’eau de Seine et de l’eau brute, et par la suite, ont été comparées avec les concentrations mesurées par chaque expérimentateur.
Pour les mélanges EB/ES (gamme haute) :
- • Soient MB0, la concentration mesurée pour l’eau de Seine (non-diluée) par le Système ALERT, le laboratoire SIAAP et le laboratoire externe et MB1/100 la concentration mesurée à dilution 1/100.
- • Les concentrations attendues pour les dilutions intermédiaires d’eau brute CABx sont calculées par régression linéaire : CABx=MB0+x*100*(MB1/100-MB0) où x correspond à la dilution effectuée x=1/500, 1/1000, 1/10000.
- • Comparaison des mesures MBx et des concentrations attendues CABx de fluidion, du laboratoire SIAAP et du laboratoire externe.
Pour les dilutions d’eau de Seine ES/ES045 (gamme basse) :
- • Soit MS1, la valeur pour l’eau de Seine (non-diluée) mesurée par le Système ALERT, le laboratoire SIAAP et le laboratoire externe.
- • Les concentrations attendues pour les dilutions intermédiaires d’eau de Seine CASx sont calculées par régression linéaire : CASx=x*MS1 où x correspond à la dilution effectuée x=1/3, 1/10, 1/30.
- • Comparaison des mesures MSx et des concentrations attendues CASx de fluidion, du laboratoire SIAAP et du laboratoire externe.
.jpg)
Les résultats de cette comparaison intrinsèque des méthodes sont présentés par la figure 10 pour la gamme de concentration inférieure à 2.500 NPP/100 ml. Une répartition homogène des mesures du système ALERT (fluidion) et des deux laboratoires est observée autour de la droite de corrélation parfaite de pente 1 (noire). De plus, le coefficient de corrélation entre les mesures attendues et mesurées pour les trois expérimentateurs a été calculé (tableau 1). Le coefficient de corrélation obtenu pour la gamme complète de concentrations par la méthode fluidion affiche une valeur intermédiaire entre les corrélations des mesures du SIAAP et du laboratoire externe.
.jpg)
La même tendance a été observée pour les mesures dont les concentrations inférieures à 2.500 NPP/100 ml, représentatives pour la problématique de la baignade, où la corrélation des mesures fluidion s’approche de celle des mesures du SIAAP, les deux restant supérieures à la corrélation des mesures du laboratoire externe. Cette différence pourrait s’expliquer par le fait que les échantillons analysés par le laboratoire externe ont subi une opération supplémentaire de transport, ce qui aurait pu altérer la qualité de certains échantillons.
Conclusion
L’étude présentée dans cet article permet, par comparaison avec la méthode de référence (NPP), de démontrer les bonnes performances métrologiques du Système ALERT de fluidion en tant qu’analyseur pour la qualité microbiologique de l’eau mesurant principalement les E. coli.
Des analyses sur la matrice réelle de l’eau de Seine ont permis d’établir une nouvelle droite d’étalonnage prenant en compte la matrice physico-chimique et bactériologique des eaux de Seine. Les résultats des expérimentations en laboratoire sur des échantillons réels et dilués de l’eau de Seine ont également permis de comparer la méthode utilisée par le Système ALERT de fluidion avec la méthode réglementaire de référence utilisée par deux laboratoires accrédités distincts, le SIAAP et le laboratoire externe. L’étude statistique des écarts entre les mesures du Système ALERT et celles des deux laboratoires confondus montre que 79 % des mesures sont à moins d’un facteur 2, et 97 % des mesures à moins d’un facteur 5 par rapport à la mesure normalisée NPP, sans aucune déviation systématique sur toute la gamme de 38 à 100.000 NPP/100 ml (3,5 unités logarithmiques). La méthode de mesure du Système ALERT montre une cohérence intrinsèque comparable à la méthode de référence NPP utilisée par les laboratoires accrédités. Les coefficients de corrélation élevés obtenus à la fois pour la gamme complète, ainsi que pour la gamme de concentrations inférieures à 2.500 NPP/100 ml, permettent de confirmer que les résultats donnés par le Système ALERT sont comparables avec les résultats de la méthode de référence.
Une deuxième étude (en cours) présentera prochainement les résultats obtenus avec le Système ALERT déployé directement in situ dans la Seine et validera ses performances analytiques en tant que station de surveillance de la qualité microbiologique. Sa résistance et sa robustesse en milieu naturel seront également jugées durant un déploiement de longue durée. La mesure des entérocoques, en cours de développement chez fluidion, fera également l’objet d’une étude de validation similaire, permettant d’étendre les performances de cette station de surveillance à toutes les bactéries importantes pour la surveillance de la baignade.
Remerciements. Les auteurs remercient l'unité chargée des analyses microbiologiques du Laboratoire d’Analyses et Prélèvements de la Direction Développement et Prospective du SIAAP pour le soutien technique apporté à ce projet.

