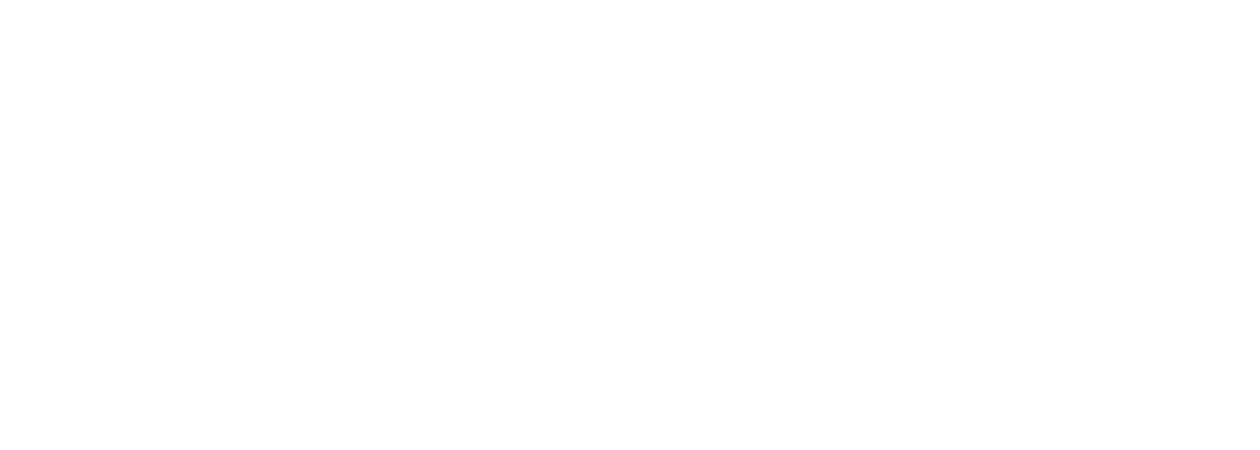La filtration percolation à travers des adsorbants naturels est une méthode efficace pour réduire les métaux lourds dans les lixiviats. Les adsorbants naturels tels que le sable, les cendres volantes, le sol argileux peuvent adsorber les métaux lourds présents dans cet effluent liquide. Les métaux lourds peuvent être adsorbés sur la surface des adsorbants naturels en raison de forces intermoléculaires faibles, en plus ils peuvent réagir avec les groupes fonctionnels présents sur la surface des adsorbants naturels pour former des complexes stables, et peuvent être échangés contre des ions présents sur la surface des adsorbants naturels.
Cette méthode de purification reste le procédé de choix, non seulement dans les zones rurales, mais aussi dans de nombreux pays industrialisés. Elle s'est révélée simple, sûre, peu coûteuse et efficace dans des conditions très diverses. Elle présente, par rapport aux autres méthodes, l’avantage considérable de tirer un meilleur parti des compétences locales et des matériaux disponibles dans les pays en voie de développement et d’éliminer la contamination bactérienne. Nous avons développé au laboratoire un système d’infiltration percolation en utilisant un lit filtrant constitué de sable marin, de cendres volantes et du sol agricole argileux. Les paramètres analysés dans cette étude sont le cadmium, le chrome, le cuivre, le fer, le plomb, le zinc et le mercure. Les résultats obtenus par ce système de traitement sont très positifs car les abattements obtenus sont évalués à plus de 80 %. Le filtrat obtenu est parfaitement dans les normes pour être utilisé pour des besoins industriels, et agricoles comme irrigation.
La production croissante des ordures ménagères et des déchets industriels entraîne des problèmes de pollution critiques. La nature de plus en plus complexe et hétérogène de ces déchets implique des difficultés pour leur traitement et leur gestion. Une grande partie est mise en décharge, sans précautions, ce qui constitue une réelle et permanente
menace pour l'environnement. Les lixiviats produits en grande quantité dans des endroits où sont entreposés des déchets très humides et sans précaution vis-à-vis de la pluviométrie sont très chargés en polluants organiques issus en particulier des réactions de fermentation. Ces lixiviats peuvent contenir beaucoup de matières organiques (biodégradables, mais aussi réfractaires à la biodégradation) constituées dans la majeure partie par des substances humiques, mais aussi par de l'azote ammoniacal, des métaux lourds, des organochlorés et des sels inorganiques. Une partie de ces lixiviats s'infiltre dans le sol qui présente des fissures, ce qui peut engendrer une pollution des eaux souterraines. Une étude d'impact et une quantification de la pollution du lixiviat s'avèrent donc nécessaires afin de pouvoir orienter correctement la collecte, le triage, la valorisation et le traitement des déchets solides.
Dans ce contexte et afin de purifier ces lixiviats, nous avons développé au laboratoire un système d'infiltration-percolation en utilisant une matrice filtrante composée de sable marin, de cendres volantes et de sol agricole argileux. Nous avons choisi ce genre de filtre naturel pour sa simplicité d’acquisition, et surtout pour son efficacité et son rendement en termes de purification. Notre recherche a été axée principalement sur la réduction des métaux lourds détectés dans ces rejets liquides. Pour donner plus de valeur à nos résultats, nous les avons confrontés à ceux de l'eau potable. Toutes les analyses ont été effectuées par ICP. Les métaux lourds que nous avons poursuivis sont le cadmium, le chrome, le cuivre, le fer, le plomb, le zinc et le mercure [1-20].
Le montage expérimental utilisé est schématisé dans la figure 1. Il s'agit d'une colonne verticale de 10 cm de diamètre et de 100 cm de hauteur. Le lit filtrant est constitué dans l'ordre précis de sable marin, de cendres volantes et de sol agricole argileux. L'alimentation du système se fait exclusivement par des lixiviats des déchets ménagers et industriels.
SUPPORTS UTILISÉS
Les adsorbants utilisés dans notre matrice filtrante sont le sable marin, les cendres volantes et le sol argileux. Ces derniers sont très riches en silices et en calcites jouant un rôle important dans la rétention des métaux lourds des lixiviats. Ces matériaux peuvent contribuer à la rétention de ces derniers par filtration mécanique et par adsorption physique, sachant que le sable peut adsorber les métaux lourds en raison de forces intermoléculaires faibles et par échange d'ions. Les cendres volantes peuvent adsorber les métaux lourds par adsorption chimique et peuvent aussi précipiter les métaux lourds en raison de réactions chimiques, et finalement par échange d'ions avec les métaux lourds présents dans les lixiviats. Finalement, le sol argileux peut adsorber les métaux lourds en raison de forces intermoléculaires faibles et de réactions chimiques.
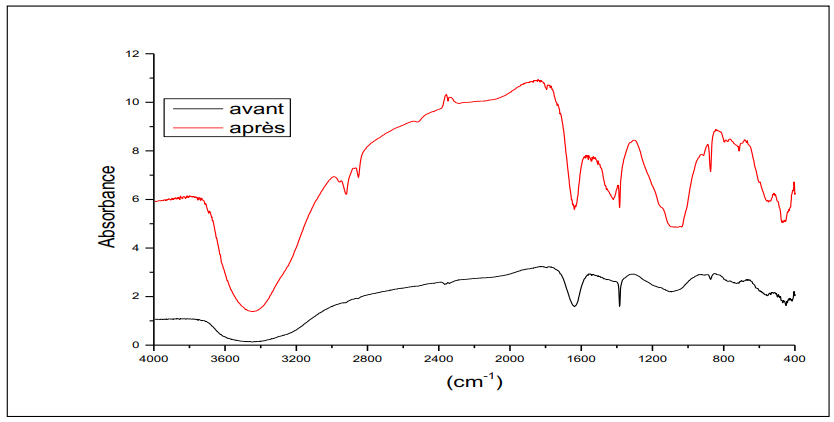
Dans le but de donner une identification plus ou moins complète des fonctions de surface des supports utilisés pour le traitement des eaux usées industrielles, ces matériaux solides ont été analysés par spectroscopie infrarouge avant et après utilisation dans la filtration de nos effluents liquides.
Le sable marin.
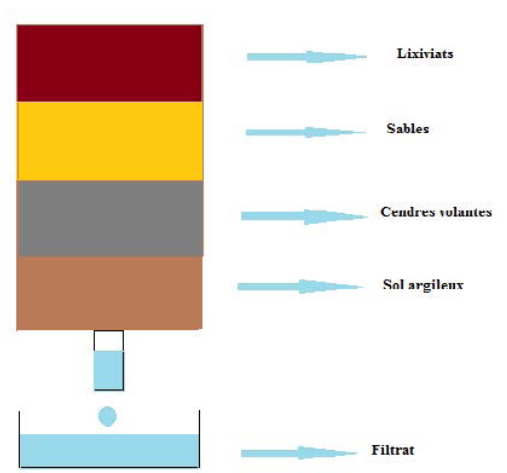
Le spectre infrarouge de l'échantillon du sable avant et après traitement (voir Figure 2), les deux dilués dans le KBr, montre la présence des bandes suivantes : une bande vers 3400 cm⁻¹ attribuée au groupement OH de l'eau, une bande faible vers 3100-2800 cm⁻¹ attribuée à des liaisons N-H dans les nitrates, fonction amine. On note la présence des bandes vers 2500-2300 cm⁻¹ attribuées aux vibrations des liaisons C-H des aromatiques.
La bande 2200-1900 cm⁻¹ est attribuée aux vibrations des liaisons C=O des esters des phtalates [51, 52]. Une bande dans la zone 1800-1200 cm⁻¹ est attribuée à la vibration des liaisons N-H et C=N dans les nitrates et amines. La bande qui apparaît dans la zone 1200-1000 cm⁻¹ caractérise les carbonates, et enfin des bandes dans la zone 700-500 cm⁻¹, attribuées à l’élongation de C-O dans les acides, alcools et phénols [21-26].
Le sol agricole.
Le spectre IR du sol agricole (voir Figure 3) présente dans la région une bande vers 3400 cm⁻¹ attribuée à des vibrations OH des groupements hydroxyles liés ou libres. La bande vers 2520 cm⁻¹ est attribuée au groupement C-H des aromatiques, et des bandes vers 2100-1900 cm⁻¹ sont attribuées aux C=O des esters des phtalates. On observe aussi des bandes caractéristiques des carbonates dans la zone 1200-1000 cm⁻¹. Enfin, des bandes à 1100 et 600 cm⁻¹ sont attribuées aux vibrations C=O des composés organiques [27-30].
Les cendres volantes.
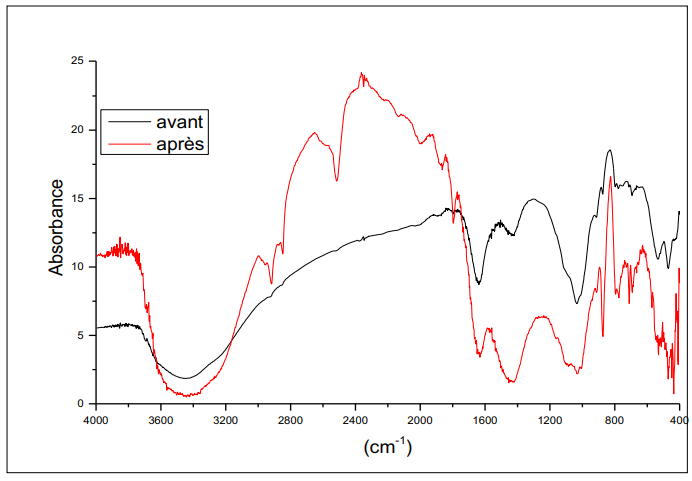
La Figure 4 représente le spectre infrarouge des cendres volantes avant traitement, diluées dans le KBr. On note la présence des bandes suivantes : une bande vers 3400 cm⁻¹ attribuée à des vibrations hydroxyle OH de l'eau. Les bandes qui apparaissent dans la zone 2800-2200 cm⁻¹ sont attribuées à des vibrations C-H des aromatiques. On note la présence d’une bande vers 2000-1000 cm⁻¹ attribuée aux vibrations des liaisons d'eau adsorbée [56]. La présence de la bande vers 1400 cm⁻¹ est liée à la vibration de déformation de NH. Les bandes vers 1000 cm⁻¹ peuvent être attribuées à des espèces carbonates ; enfin des bandes 900-500 cm⁻¹ expriment la vibration des liaisons Si-O-Si ou Si-O-Al [31-38].
RÉSULTATS ET DISCUSSIONS
Les lixiviats étudiés proviennent des dépôts des déchets ménagers et industriels. Ces derniers ont été analysés soigneusement par ICP (Inductance Couplage Plasma). Le tableau 1 présente en ppm la concentration de quelques éléments toxiques à savoir le cadmium, le chrome, le cuivre, le fer, le plomb, le zinc et le mercure.
Dans le tableau 2, nous avons exposé les valeurs en ppm de ces mêmes métaux lourds dans le filtrat obtenu après filtration par nos adsorbants. Pour valider les résultats obtenus, nous avons jugé très utile et intéressant de faire une comparaison avec l'eau potable, que nous avons aussi analysée par ICP (tableau 2). Les résultats du tableau 2 sont présentés par des histogrammes présentés par les figures 5, 6, 7, 8, 9 et 10.
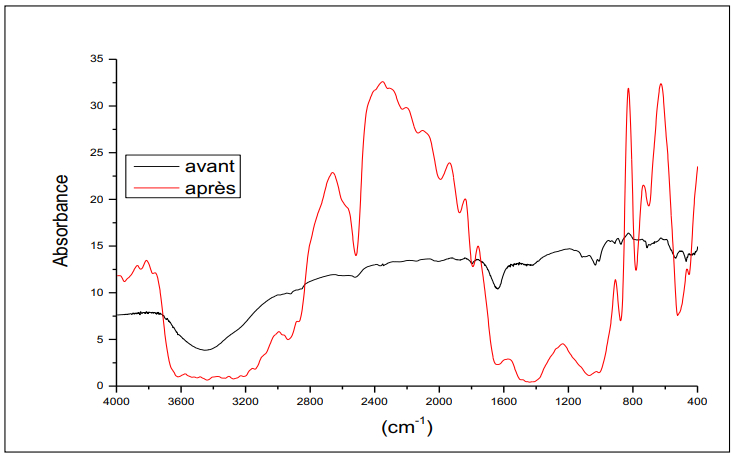
Tableau 1 : Analyse par ICP des lixiviats étudiés avant filtration.
| Métaux lourds | Valeurs en ppm |
|---|---|
| Cd | 0,022 |
| Cr | 0,21 |
| Cu | 0,27 |
| Fe | 5,42 |
| Pb | 0,16 |
| Zn | 3,32 |
| Hg | 0,09 |
Tableau 2 : Analyse par ICP des lixiviats étudiés après filtration.
| Métaux lourds | Lixiviats | Filtrat | Eau potable |
|---|---|---|---|
| Cd | 0,022 | 0,011 | 0,001 |
| Cr | 0,21 | 0,09 | 0,007 |
| Cu | 0,27 | 0,13 | 0,02 |
| Fe | 5,42 | 1,03 | 0,01 |
| Pb | 0,16 | 0,05 | 0,009 |
| Zn | 3,32 | 1,08 | 0,06 |
| Hg | 0,09 | 0,001 | 0,001 |
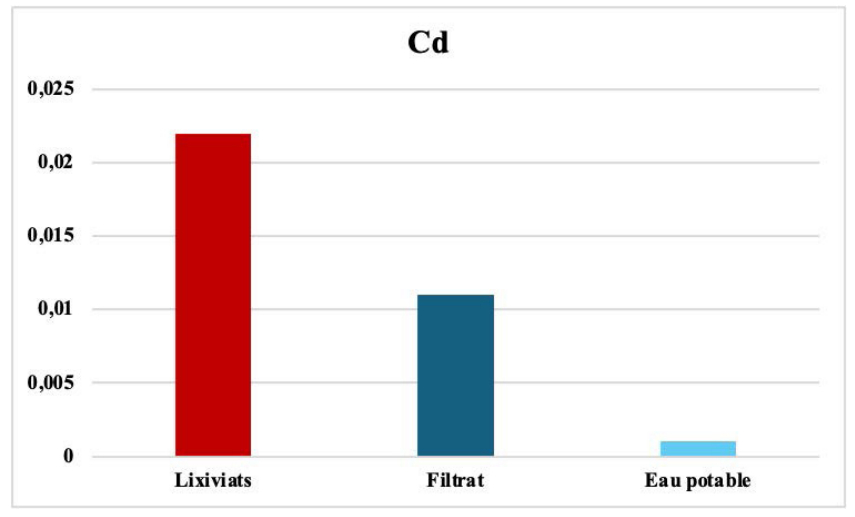
Le cadmium avant et après filtration. Le cadmium est un métal lourd qui peut causer des problèmes de santé graves, notamment des troubles du système rénal et des dommages aux os. Le taux de cadmium dans les lixiviats provient de la production de fertilisants non naturels à base de phosphate et aux rejets industriels liés à la métallurgie. Son traitement à travers le filtre utilisé a diminué la concentration du cadmium de 0,022 ppm à 0,011 ppm (voir Figure 5). Cet abattement est expliqué par l'immobilisation au niveau du substrat via des mécanismes tels que l'adsorption au niveau des sites d’échanges, la fixation à la matière organique, l'incorporation dans la structure du sol et par précipitation sous forme de composés insolubles [39-42].
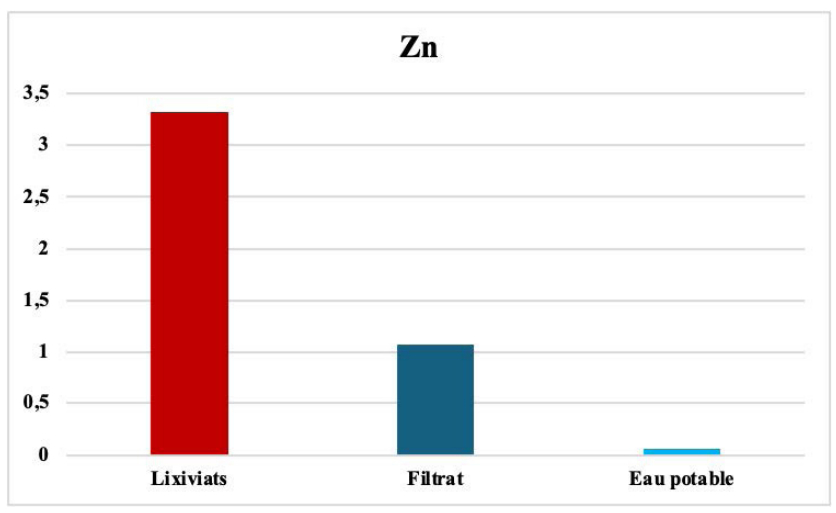
Le zinc avant et après filtration. Le zinc présent dans les lixiviats peut provenir, que ce soit des déchets ménagers, tels que les batteries, les appareils électriques et les produits de soins personnels, des déchets industriels, tels que les déchets de l'industrie chimique, de l'industrie minière et de l'industrie sidérurgique, ou des déchets de construction, comme les déchets de plâtre et de ciment. Le zinc peut être toxique pour les organismes vivants, notamment les poissons et les plantes, et peut s'accumuler dans les organismes vivants et causer des problèmes de santé graves. Il peut contaminer les eaux souterraines et superficielles, ce qui peut affecter la qualité de l'eau et la santé des organismes aquatiques. Le zinc relativement mobile est facilement adsorbé.
par les constituants du sol argileux (voir Figure 6). [43-48].
Le plomb avant et après filtration.
Le plomb est un métal lourd qui peut causer des problèmes de santé graves, notamment des troubles du développement chez les enfants et des dommages aux organes chez les adultes, comme les troubles du système nerveux et des dommages aux organes.
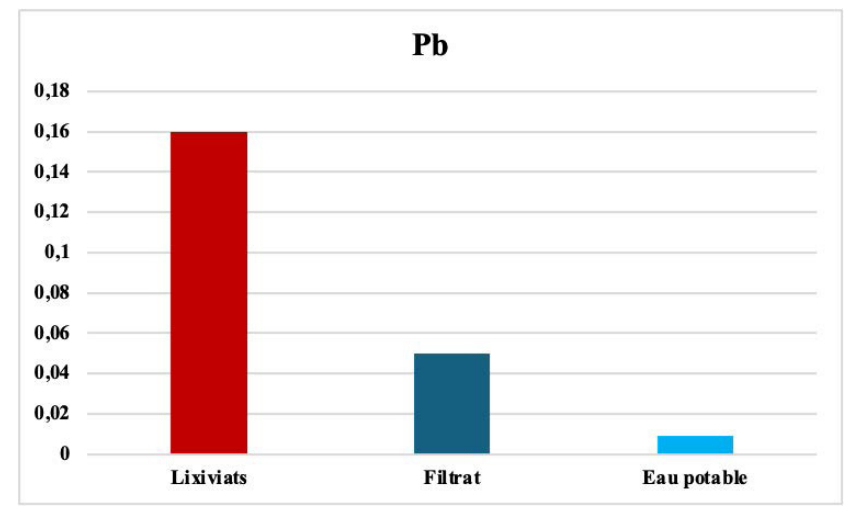
Ce dernier peut être présent dans les eaux usées en raison de diverses sources de pollution, tels que les déchets de l'industrie chimique et de l'industrie minière, des déchets ménagers, tels que les batteries et les produits de soins personnels, des systèmes de plomberie, notamment les tuyaux et les robinets, des peintures et les revêtements. Le plomb peut s'accumuler dans les organismes vivants, notamment les poissons et les oiseaux, et causer des problèmes de santé graves.
La purification, par notre matrice, a permis une réduction de 98 % (voir Figure 7). L'abattement du plomb s'explique par les différents minéraux argileux existants dans le sol argileux, particulièrement la palygorskite. [49-53].
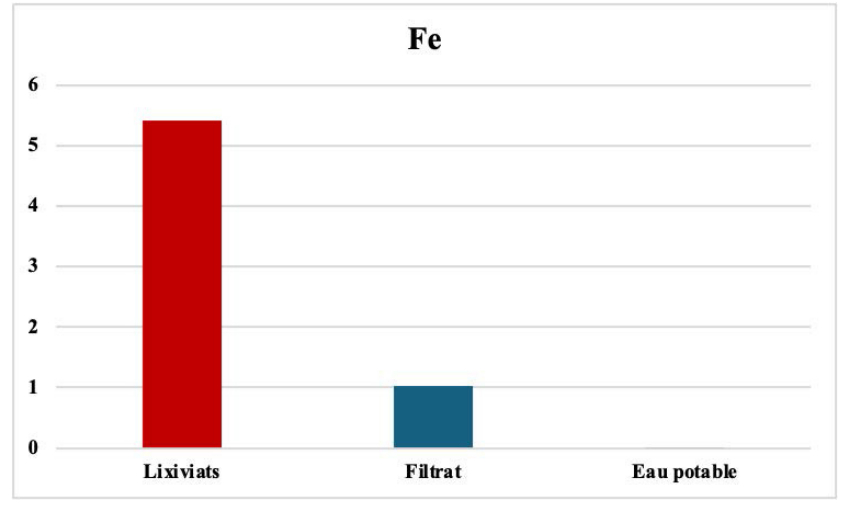
Le fer est l'un des métaux les plus abondants de la croûte terrestre. Il est présent dans l'eau sous trois formes, le fer ferreux Fe²⁺, le fer ferrique Fe³⁺ et le fer complexé à des matières organiques (acides humiques, fulviques, tanniques...). Son origine au niveau industriel peut s'expliquer par l'exploitation minière, la sidérurgie, la corrosion des métaux. Le fer donne aussi un goût métallique à l’eau rendant désagréable sa consommation.
La filtration des eaux usées, par nos adsorbants, a permis une réduction de cet élément de 99 % (voir Figure 8). Cette élimination est due à des micro-organismes présents dans le sol, le sable et les cendres volantes. [54-60].
Le cuivre avant et après filtration.
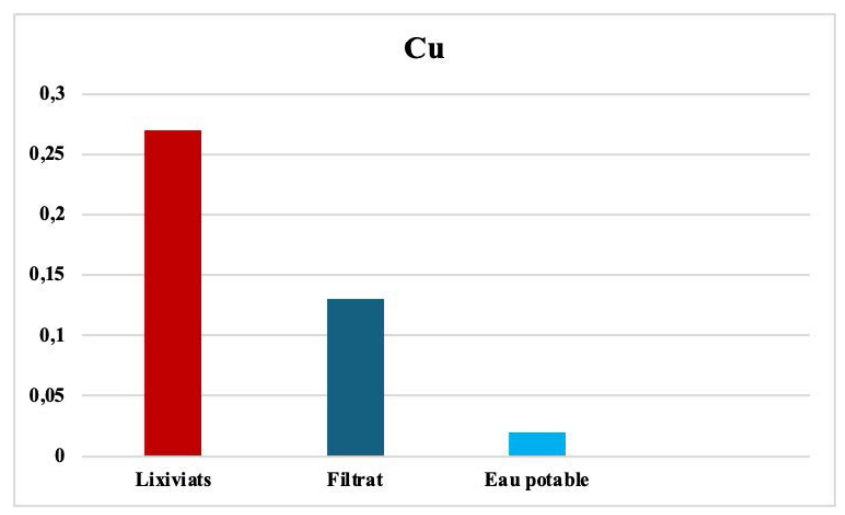
Le cuivre provient principalement des rejets industriels comme le traitement de surface, l'industrie chimique et électronique. Le dosage du cuivre dans l'eau percolée révèle une teneur de l'ordre de 0,02 ppm pour le filtrat récupéré, ce qui correspond au rendement épuratoire de 97 %.
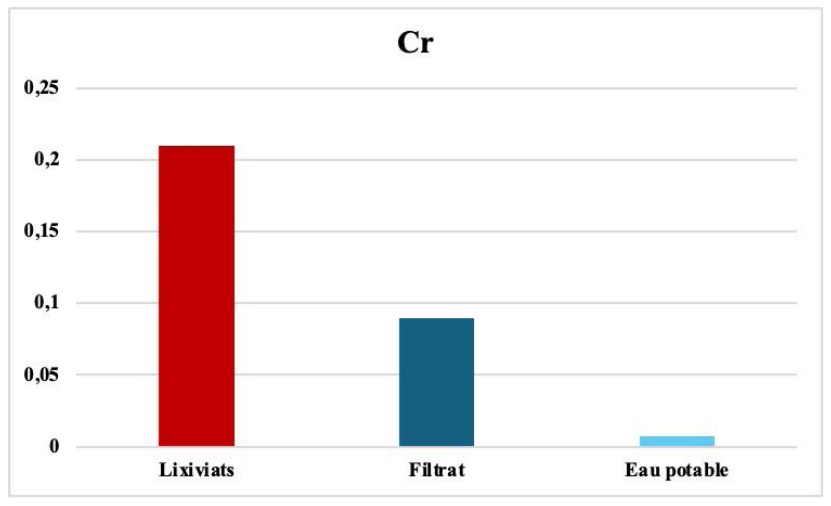
Le chrome avant et après filtration. Le chrome est un métal lourd toxique qui peut causer des problèmes de santé graves, notamment des troubles du système respiratoire et des dommages aux organes. Le chrome présent dans les lixiviats en raison de diverses sources de pollution, à savoir les déchets industriels, tels que les déchets de l'industrie chimique et de l'industrie minière, des déchets ménagers, tels que les batteries et les produits de soins personnels, des systèmes de plomberie notamment les tuyaux et les robinets, et de l'industrie du cuir qui peut libérer du chrome dans les eaux usées en raison de l'utilisation de produits chimiques contenant du chrome. La teneur du chrome détectée dans les lixiviats a été réduite de 90 % par notre filtre, comme le montre clairement la figure 10. Cet abattement s'explique par des phénomènes de précipitation et d’adsorption qui jouent certainement un rôle d’atténuateur de la toxicité de cet élément [65-67].
CONCLUSION
La technique de filtration percolation des lixiviats des déchets ménagers et industriels par des adsorbants naturels poreux riches en silices et en calcites tels le sable marin, les cendres volantes et le sol argileux a permis efficacement de réduire la matière organique et les métaux lourds de plusieurs manières :
Filtration mécanique. Le sable, les cendres volantes et le sol argileux peuvent retenir les particules et les colloïdes qui contiennent de la matière organique.
Adsorption physique et chimique. Le sable, les cendres volantes et le sol argileux peuvent adsorber la matière organique en raison de forces intermoléculaires faibles et de réactions chimiques.
Dégradation biologique. Les micro-organismes présents dans le sable, les cendres volantes et le sol argileux peuvent dégrader la matière organique en composés plus simples.
Adsorption physique et chimique. Le sable, les cendres volantes et le sol argileux peuvent adsorber les métaux lourds en raison de forces intermoléculaires faibles et de réactions chimiques.
Échange d’ions. Le sable, les cendres volantes et le sol argileux peuvent échanger des ions avec les métaux lourds, ce qui peut réduire leur concentration.
Précipitation. Les métaux lourds peuvent précipiter en raison de réactions chimiques avec les composés présents dans le sable, les cendres volantes et le sol argileux.
La filtration peut réduire la turbidité de l’eau, ce qui peut réduire la concentration de la matière organique et des métaux lourds et la charge organique de l’eau, ce qui peut réduire la concentration de la matière organique et des métaux lourds, ce qui peut réduire les risques pour la santé et l’environnement. Les résultats obtenus nous ont permis de déduire, dans des conditions précises, que les supports étudiés présentent un pouvoir efficace pour réduire la charge polluante organique et minérale présente dans les eaux usées étudiées, avec un taux de réduction de la pollution moyen dépassant les 80 % pour tous les paramètres physicochimiques analysés.
En comparant les spectres infrarouges des supports solides ayant servi à la filtration des eaux usées, on peut conclure qu’il y a une faible modification des spectres infrarouge avant et après traitement, ce qui confirme qu’il y a une adsorption de composés organiques.
En utilisant ce procédé de traitement, nous avons obtenu des eaux usées filtrées qui répondent aux limites normalisées pour les rejets liquides dans les milieux récepteurs (lacs, rivières, océans… etc.). Ces eaux filtrées peuvent être recyclées et utilisées en agriculture et pour l’irrigation des espaces verts.
ABD-ALLAH S, MAHDY R. Characterization of some clay sediments in Egypt for safe environmental applications. Basic and Applied Sciences, 2007, Vol. 4, pp. 813-823.
RASHED M.N., SOLTAN M.E. Removal of heavy metals from urban wastewater using aeration, alum and kaolin. Hydrology, 2001, No. 45, UNESCO, Paris.
BHATTACHARYYA K.G., GUPTA S.S. Adsorption of a few heavy metals on natural and modified kaolinite. Colloid Interface Sci., Aug 2008, Vol. 5, pp. 14-31.
SUSMITA S., G., KRISHNA G. Adsorption of heavy metals on kaolinite, montmorillonite. Physical Chemistry, 2012, pp. 12.
MULLINS G., MITCHELL C. Wheat forage response to tillage and sulfur applied as phosphogypsum. Orlando, publication FIPR, 1990, Vol. 1, pp. 361-375.
MOUTAOUAKIL A., PINEAU J.L., LAHLOU K. « La recherche d'un procédé viable de valorisation d'un phosphogypse provenant de l'industrie phosphatière marocaine ». Déchets Sciences et Techniques, 2003, Vol. 29, pp. 31-35.
KOULOHERIS A.P. Chemical nature of phosphogypsum as produced by various wet phosphoric acid processes. First International Symposium on Phosphogypsum, publication, Florida, 1980, pp. 5-7.
MARIA V., LUMINITA I., ANCA D. Fly ash adsorbents for multi-cation wastewater treatment. Applied Surface Science, 2012, 258, pp. 6345-6352.
LAAMYEM A., NAJEM M., MONKADE M., ZRADA A., RADOUANI N. Revalorisation des cendres volantes dans le traitement des eaux usées industrielles de la ville d'El Jadida. Revue EIN 332, pp. 101-104.
REVIL A., LEROY P., TITOV K. Characterization of transport properties of argillaceous sediments. Journal of Geophysical Research, 2005, Vol. 110, B06202.
SANTÉ CANADA. Recommandations pour la qualité de l'eau potable au Canada : la turbidité. Comité fédéral provincial territorial sur l'eau potable, Ottawa, 2003, pp. 36.
SCHNITZER M., KAHN S.H. Humic substances in the environment. Marcel Dekker, New York, N.Y., 1972, pp. 204.
CHAPMAN D. Water quality assessment. A guide to the use of biota, sediments and water in environmental monitoring. Londres, 1992.
COBB D.G., FLANNAGAN J. Effects of discharge and substrate stability on density and species composition of stream insects. J. Sci. Halieutiques, 1996, pp. 1788-1795.
RODIER J. L'analyse de l'eau naturelle, eaux résiduaires, eau de mer. 8e éd., Denod, Paris, 1996, Vol. 1, pp. 1383.
ZH H.M., WANG B. Multifunctional micronized modified kaolin and its application in wastewater treatment. Hazardous Materials, 2006, pp. 365-370.
ESSA M., FARRAGALLAH M. Clay minerals and their interaction with heavy metals and microbes of soils irrigated by various water resources. Environmental Research, 2006, pp. 73-90.
SHEN Y.H. Phenol sorption by organoclays having different charge characteristics. Physicochem., 2004, Vol. 232, pp. 143-149.
GUPTA K., MOHAN D. Utilization of bagasse fly ash for the removal and recovery of phenol and p-nitrophenol from wastewater. Biotechnol., 1998, Vol. 71, pp. 180-186.
HEDGE R., MCLELLAN M. Archaeometry, 1976, Vol. 18, pp. 203.
WEI-SHENG C., FANG-CHIH C., YUN-HWEI S., MIN-SHING T., CHUN-HAN K. Removal of chloride from MSWI fly ash. Hazardous Materials, 2012, pp. 116-120.
MAHMOUD M., AHMED M. Abatement of free chlorine from water using kaolinite. Environmental Research, 2004, Vol. 7, pp. 237-238.
ERICKSON E., AFFARTH K., HENZE M., LEDIN A. Characteristics of grey wastewater. Urban Water, 2002, 4, pp. 85-104.
UDERT K., GUJER W. Urea hydrolysis and precipitation dynamics in a urine-collecting system. Water Research, 2003, pp. 2571-2582.
BONTE S.L., PONS M., POTIER O., ROCKLIN P. Relation between conductivity and ion content in urban wastewater. Journal of Water Science, 2008, Vol. 21, pp. 429-438.
PIVATO A. Tests for the evaluation of ammonium attenuation in MSW landfill leachate by adsorption into bentonite. Waste Management, 2006, Vol. 26, pp. 123-132.
WEBER M., WESTFALL D. Ammonium adsorption by a zeolite in a static and a dynamic system. J. Environ. Qual., 1983, Vol. 12, p. 549-552.
BURAGOHAIN D., SREDEEP S., SAIYOURIN A. Study on the adsorption of ammonium in bentonite and kaolinite. JCEBS, 2013, pp. 2320-4087.
HAMMER M.J., HAMMER Jr. Water and wastewater technology. 4th Edition, Prentice Hall of India, New Delhi, 2005.
DU CHAUFOUR P. Abrégé de pédologie : sol, végétation et environnement. 5e éd., Masson, 1997.
COMITÉ NORMES ET STANDARDS. Ministère de l'Environnement du Maroc, 1994, Rabat.
FURUMAI H., KHAKI S. Adsorption-désorption du phosphate par le sédiment lacustre en conditions anaérobies. Water Research, 1989, Vol. 23, pp. 677-683.
WIELAND E., STUMM W. Dissolution kinetics of kaolinite in acidic aqueous solutions at 25 °C. Geochimica et Cosmochimica Acta, 1992, Vol. 56, pp. 3339-3355.
XIAOMIN L., YANRU T., XIUJU C., DANDAN L., FANG L., WENJING S. Preparation and evaluation of orange peel cellulose adsorbents for effective removal of Cd, Zn, Co and Ni. Colloids and Surfaces, 2008, Vol. 317, pp. 512-521.
SUANTAK K., SURESH S., MAJUMDER C.B., CHAND S. Characterization of banana and orange peels: biosorption mechanism. Sci Technology & Management, 2011, Vol. 2.
MAFRA S. Humic acids from hydromorphic soils of the upper Negro River basin, Amazonas: chemical and spectroscopic characterization, 2006.
ALLAHVERDI A., KANI N.E., YAZDANIPOUR M. Effects of blast-furnace slag on natural pozzolan-based geopolymer cement. Ceramics, 2011, Vol. 55, pp. 68-78.
TCHAKOUTE K., NJOPWOUO D. Effect of adding alumina oxide to metakaolin and volcanic ash on geopolymer products. Construction and Building Materials, 2012, Vol. 35, pp. 960-969.